基金项目:国家科技部重大专项(2016YFC1303702);重庆市科技局与卫健委联合中医药技术创新与应用发展资助项目(2020ZY013540);重庆市科技局与卫健委联合技术创新与应用发展项目面上项目(2021MSXM311);重庆市沙坪坝区决策咨询与管理创新项目(Jcd202038)。
通信作者:周 琦
E-mail: qizhou9128@163.com
通信作者简介
周 琦,重庆大学附属肿瘤医院妇科肿瘤中心主任医师、教授、博士生导师。现任国际妇癌联盟(IGCS)教育委员会委员、中国抗癌协会妇科肿瘤专委会(CGCS)前任主任委员、中国抗癌协会内分泌专业委员会主任委员、中国医疗保健国际交流促进会妇产科专业委员会副主任委员、中国临床肿瘤学会妇科肿瘤专家委员会副主任委员、中国优生科学协会CSCCP副主任委员。是中国科协第六批首席科学传播专家,担任重庆市医师协会肿瘤医师分会会长,重庆市肿瘤学学术技术带头人,重庆市医学首席专家。主要研究方向为妇科恶性肿瘤放化疗抗性研究,肿瘤早期诊断方法研究,肿瘤的个体化靶向治疗、免疫治疗的相关临床与应用基础研究,肿瘤精准治疗及相关基因诊断研究。擅长妇科恶性肿瘤的手术、放疗和化疗,肿瘤遗传咨询和晚期妇科恶性肿瘤手术及挽救性治疗。
肿瘤相关性高血糖管理指南(2021年版)
中国抗癌协会肿瘤内分泌专业委员会,重庆市中西医结合学会肿瘤内分泌分会
[摘要]恶性肿瘤逐渐成为中国最常见的威胁生命的慢性非传染性疾病,近年来研究发现,恶性肿瘤与高血糖及糖尿病关系密切。一方面,高血糖和糖尿病可以增加多种恶性肿瘤的发病率,且与其不良预后密切相关。另一方面,部分肿瘤本身可导致高血糖和糖尿病。此外,在治疗恶性肿瘤的过程中也会出现高血糖和糖尿病。以上统称为肿瘤相关性高血糖,但目前尚无相关的指南可用于指导临床诊治和管理。中国抗癌协会肿瘤内分泌专业委员会和重庆市中西医结合学会肿瘤内分泌分会组织专家对肿瘤相关性高血糖的研究进展进行归纳总结,旨在及时传递重要信息,指导临床实践。本指南主要涵盖肿瘤相关性高血糖的概述、临床诊治管理和长期随访管理,将有助于临床医师对肿瘤相关性高血糖患者进行规范化管理,改善中国肿瘤相关性高血糖患者的临床结局。
[关键词]肿瘤相关性高血糖;管理;指南
[Abstract]Malignant tumors have gradually become the most common chronic non-communicable diseases in China. Recent research has indicated that malignant tumors are closely associated with hyperglycemia and diabetes. On one hand, hyperglycemia and diabetes increased the morbidity of many malignant tumors, and are related to their poor prognosis. On the other hand, some tumors can also cause hyperglycemia and diabetes. In addition, hyperglycemia and diabetes may occur during the treatment of malignant tumor. These are all described as tumor-associated hyperglycemia. However there is no relevant guidance for clinical diagnosis, treatment and management. Experts from the Onco-endocrinology Society of Chinese Anti-Cancer Association and Onco- endocrinology Society of ChongQing Integrative Medicine Association summarized the research progress of tumor-associated hyperglycemia, aimed to transmit recent important progress and guide clinical practice. This guideline mainly covered the overview of tumor-associated hyperglycemia, clinical diagnosis, treatment and long-term follow-up management. This guideline may help clinicians to standardize the management of patients with tumor-associated hyperglycemia, and improve the clinical outcomes of patients with tumor-associated hyperglycemia in China.
[Key words]Tumor-associated hyperglycemia; Management; Guidelines
肿瘤相关性高血糖管理指南(2021年版)
编写专家
执笔专家:
周 琦 重庆大学附属肿瘤医院
吴绮楠 重庆大学附属肿瘤医院
李 强 深圳大学总医院
李因涛 山东省肿瘤医院
于常华 深圳大学总医院
蒲丹岚 重庆大学附属肿瘤医院
鹿 斌 复旦大学附属华山医院
韩 睿 昆明医科大学第一附属医院
蒋 娟 重庆大学附属肿瘤医院
李乃适 中国医学科学院北京协和医院
陈 兵 陆军军医大学第一附属医院
王树森 中山大学肿瘤防治中心
张师前 山东大学齐鲁医院
参与撰写和讨论本共识的专家(以姓名汉语拼音字母为序):
蔡红兵 武汉大学中南医院
蔡建良 首都医科大学附属北京世纪坛医院
陈 兵 陆军军医大学第一附属医院
陈 宏 南方医科大学珠江医院
陈 洁 中山大学附属第一医院
程庆丰 重庆医科大学附属第一医院
邓武权 重庆大学附属中心医院
郭 莉 新疆医科大学附属肿瘤医院
韩 睿 昆明医科大学第一附属医院
蒋翠萍 复旦大学附属华东医院
蒋 娟 重庆大学附属肿瘤医院
蒋 升 新疆医科大学第一附属医院
雷小添 陆军军医大学第一附属医院
冷蔚玲 陆军军医大学第一附属医院
李乃适 中国医学科学院北京协和医院
李 强 深圳大学总医院
李晓林 江苏省人民医院
李艳娇 山西医科大学第二医院
李因涛 山东省肿瘤医院
练 渝 重庆市北部宽仁医院
梁勇前 南方医科大学顺德医院
廖 鑫 遵义医科大学附属医院
廖 涌 武警重庆总队医院
隆 敏 陆军军医大学第二附属医院
娄 阁 哈尔滨医科大学附属肿瘤医院
鹿 斌 复旦大学附属华山医院
蒲丹岚 重庆大学附属肿瘤医院
田建卿 厦门弘爱医院
万 沁 西南医科大学附属医院
王丹波 辽宁省肿瘤医院
王树森 中山大学肿瘤防治中心
王 莉 河南省肿瘤医院
向 阳 中国医学科学院北京协和医院
徐书杭 江苏省中西医结合医院
吴绮楠 重庆大学附属肿瘤医院
吴永忠 重庆大学附属肿瘤医院
杨刚毅 重庆医科大学附属第二医院
杨 雁 华中科技大学同济医学院附属同济医院
于常华 深圳大学总医院
赵健洁 陆军特色医学中心
邹冬玲 重庆大学附属肿瘤医院
张师前 山东大学齐鲁医院
张友忠 山东大学齐鲁医院
周广举 川北医学院附属医院
周 琦 重庆大学附属肿瘤医院
1证据分级系统和证据水平的定义
A级:来自实施良好、代表性广泛的随机对照试验的明确证据,包括:① 实施良好的多中心临床试验;② 分析时纳入质量评分的meta分析。令人信服的非试验来源的证据,如英国牛津大学循证医学中心开发的“全或无”规则。来自实施良好的随机对照试验的支持性证据,包括:① 1个或多个研究机构实施良好的证据;② 分析时纳入质量评分的meta分析。
B级:来自实施良好的队列研究的支持性证据,包括:① 实施良好的前瞻性队列研究或注册研究;② 实施良好的队列研究的meta分析。来自一项实施良好的病例对照研究的支持性证据。
C级:来自对照不严谨或无对照研究的支持性证据,包括:① 存在1个或多个主要,亦或3个或多个次要方法学缺陷的随机临床试验;② 观察性研究,可能具有较大偏倚(如前后对照的病例系列);③ 病例系列或病例报告。
D级:有冲突的证据,但大体上支持推荐。
E级:专家共识或临床经验。
2肿瘤相关性高血糖概述
2.1 肿瘤相关性高血糖的流行病学
糖尿病和恶性肿瘤作为严重威胁人类健康的两类常见疾病,发病率呈逐年上升趋势,越来越多的研究显示,恶性肿瘤与糖尿病关系密切。
2.1.1 糖尿病与肿瘤的相关性
2型糖尿病与一些恶性肿瘤的发病率关系密切,糖尿病患者的恶性肿瘤发生率明显增加,最常见的肿瘤为消化道肿瘤(如结肠癌、直肠癌、肝癌、胰腺癌、胃癌及胆管癌等),乳腺癌、子宫内膜癌及肾癌都与糖尿病有一定的相关性。其他与糖尿病相关的肿瘤还包括黑色素瘤和血液系统肿瘤[1]。
糖尿病患者患结直肠癌的风险是非糖尿病患者的1.72倍,结直肠癌组有糖尿病家族史的比例显著高于对照组[2]。从性别上看,男性糖尿病患者患结肠癌的风险升高,而女性糖尿病患者则无明显升高[3-4]。与既往无糖尿病和肺癌的人群相比,既往有糖尿病的无肺癌人群肺癌的发病率更高,且随着糖尿病病程的增加而逐渐增加[5]。同时,糖尿病是肝癌发生的独立危险因素,糖尿病患者患肝癌的风险可增加2倍[6]。糖尿病患者与非糖尿病患者相比,乳腺癌的发病率显著升高[7]。即使是妊娠期糖尿病妇女,也较正常妊娠者有更高的胰腺癌发病风险[8]。糖尿病患者发展成非霍奇金淋巴瘤的风险更高[9]。从新发肿瘤风险来看,与非糖尿病人群相比,糖尿病人群多种新发肿瘤风险升高,其中男性患者前列腺癌、血液系统恶性肿瘤(白血病、淋巴瘤)、皮肤癌、甲状腺癌、肾癌、肝癌、胰腺癌、肺癌、结直肠癌和胃癌的风险明显升高;女性患者鼻咽癌、肝癌、食管癌、甲状腺癌、肺癌、胰腺癌、白血病、淋巴瘤、子宫体癌、结直肠癌、乳腺癌、子宫颈癌和胃癌的风险明显升高[10]。因此,糖尿病患者中多种恶性肿瘤风险均明显升高。
2.1.2 糖尿病对肿瘤患者预后的影响
糖尿病人群的恶性肿瘤患病率较高,且肿瘤分期较晚,治疗效果较差,预后不良。首先,糖尿病患者的所有恶性肿瘤致死率均增加,包括结直肠癌、乳腺癌、子宫体癌、卵巢癌和非霍奇金淋巴瘤[11]。就单个癌种而言,糖尿病患者与非糖尿病患者相比,乳腺癌分级更高,分期更晚,死亡率显著升高[7,12]。并发2型糖尿病的胃癌患者术后并发症发生率和病死率较高,术后近期的不良结局显著增加[13]。胰腺癌病死率也与糖尿病存在明显的相关性,糖尿病患病率越高,胰腺癌的病死率越高,糖尿病患病率每升高1%,胰腺癌病死率升高19%,即使调整年龄后也升高3%[14]。与非糖尿病人群相比,患肺癌合并糖尿病的人群生存期明显缩短,生存率均明显下降[15]。因此,高血糖和糖尿病与多种恶性肿瘤的不良预后关系密切。
2.1.3 肿瘤患者中高血糖的比例
17%以上的肿瘤患者伴有糖尿病和血糖异常升高[16]。近1/3的胰腺癌患者符合糖尿病诊断标准[17]。一半或更多的胰腺导管癌患者有糖尿病或高血糖,20 %~25%的患者在诊断胰腺癌前6~36个月被诊断为糖尿病[18]。调整年龄、性别后,与恶性肿瘤相关的糖尿病危险比(hazard ratio,HR)显著增加,在恶性肿瘤诊断后的2年内,患糖尿病的风险最高,且具有延续性:胰腺癌(HR=5.15)、肾癌(HR=2.06)、肝癌(HR=1.95)、胆囊癌(HR=1.79)、肺癌(HR=1.74)、血液系统恶性肿瘤(HR=1.61)、乳腺癌(HR=1.60)、胃癌(HR=1.35)、甲状腺癌(HR=1.33)[19-20]。由此可见,恶性肿瘤患者中高血糖和糖尿病的比例明显升高。
3肿瘤相关性高血糖的主要病因
3.1 肿瘤本身相关
肿瘤本身对糖代谢的影响与肿瘤细胞能量代谢特点、分泌异位激素及肿瘤细胞的破坏作用密切相关。一方面,肿瘤患者血糖升高与肿瘤细胞在有氧条件下摄取葡萄糖并产生乳酸有关(Warburg效应),另一方面,嗜铬细胞瘤、肾上腺皮质肿瘤、垂体肿瘤、胰高血糖素瘤等引起儿茶酚胺类激素、肾上腺皮质激素、胰高血糖素等拮抗胰岛素的升糖激素分泌增加,或小细胞肺癌等神经内分泌肿瘤异位分泌的激素(如胰高血糖素、促肾上腺皮质激素、肾上腺皮质激素、异源生长激素、血清胰淀粉样肽等),这些激素可诱发胰岛素抵抗,引起糖代谢异常,血糖升高。此外,发生于胰腺的肿瘤,随着肿瘤细胞的生长可以直接破坏胰岛β细胞,使胰岛素合成和分泌减少,血糖升高。
3.2 肿瘤治疗相关
3.2.1 免疫检查点抑制剂治疗相关性高血糖
自身免疫性糖尿病是免疫检查点抑制剂治疗的一种免疫相关不良反应。免疫检查点抑制剂诱导的糖尿病主要表现为严重且持续的胰岛素缺乏,其特征为:① 糖尿病酮症酸中毒(diabetic ketoacidosis,DKA),胰岛素C肽水平低或缺乏,多数患者急性起病,临床表现多样,起病前可无流感样症状,患者可在短时间内出现高血糖或DKA,糖化血红蛋白(glycosylated hemoglobin,HbA1c)可轻度或明显升高;② 在急性诊断期后至少数周至数个月内出现胰岛素依赖,胰岛功能衰竭快,多数患者起病时C肽水平低或检测不出,几乎无残存的胰岛功能,需要依赖胰岛素治疗;③ 几乎不可逆且类固醇激素治疗不能逆转细胞功能障碍;④ 免疫抑制剂诱导的糖尿病患者中49%呈现胰岛自身抗体阳性,以谷氨酸脱羧酶抗体(GAD65抗体)最常见;⑤ 易合并其他内分泌腺体受损,包括甲状腺、垂体、肾上腺等,其中甲状腺腺体损伤发生率较高。
可能的发生机制:免疫检查点抑制剂启动胰岛抗原特异性CD8+T淋巴细胞浸润增加,淋巴细胞毒效应增强,破坏胰岛β细胞,胰岛素分泌减少或完全缺乏[1]。程序性死亡[蛋白]-1(programmed death-1,PD-1)/程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)相互作用可通过抑制自身反应性T淋巴细胞的活化而发挥避免自身免疫性糖尿病发生的作用。主要发生在使用PD-1/PD-L1抑制剂的患者中,而使用溶细胞性T淋巴细胞相关抗原4(cytolytic T lymphocyte associated antigen-4,CTLA-4)抑制剂的患者不会出现高血糖和糖尿病。
3.2.2 手术治疗相关性高血糖
由于自身疾病产生的焦虑、抑郁、自卑等负面情绪和手术造成的创伤、术后疼痛等使患者处于一种应激状态,导致下丘脑-垂体-肾上腺皮质轴和交感神经系统的激活[2],出现应激性高血糖。其发生机制包括:① 胰岛素受体(insulin receptor,IR)介导的信号转导中许多环节障碍均可导致胰岛素抵抗的发生[3]。② 手术创伤、术中麻醉、疼痛、心理等因素使机体发生应激反应,交感神经兴奋激活下丘脑-垂体-肾上腺皮质轴,释放大量的升糖激素,通过作用于胰岛β细胞膜上的α受体抑制胰岛素分泌,同时胰高血糖素与肝细胞膜上胰高血糖素受体结合,激活糖异生有关的酶,使血糖升高;此外,皮质醇和儿茶酚胺均可促进糖异生,抑制胰岛素分泌[2]。③ 应激状态下,机体释放大量损伤胰岛β细胞的促炎性细胞因子,诱导胰岛β细胞凋亡,并可通过STAT3-SOCS3信号转导通路影响IR信号转导通路的转导,增强胰岛素抵抗,降低外周葡萄糖的利用率;以上因素共同导致胰岛素分泌减少,引起血糖升高[2-5]。
3.2.3 化疗相关性高血糖
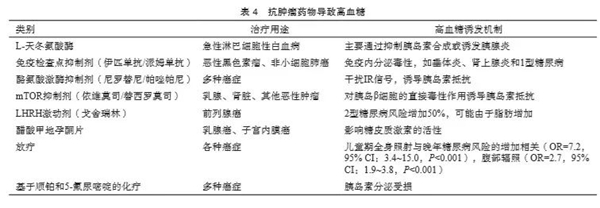
某些化疗药物,如顺铂、紫杉醇、环磷酰胺、甲氨蝶呤、L-左旋门冬酰胺酶、泼尼松等可诱发糖尿病。其可能发生的机制如下:
⑴ 化疗药物直接毒性:化疗药物如铂类药物、环磷酰胺等在杀伤肿瘤细胞的同时也可损伤胰岛β细胞,导致胰岛素分泌减少,糖耐量异常,血糖升高。
⑵ 化疗药物间接毒性:肝脏是进行三大营养物质代谢的主要脏器,包括糖原合成和糖的分解、蛋白质及脂肪的分解与合成,以及维生素和激素的代谢等。细胞毒性化疗药物可引起肝功能损伤,引起糖代谢异常,导致葡萄糖的摄取和肝糖原合成发生障碍,使血糖升高。
⑶ 化疗辅助药物的使用:某些化疗药物,如紫杉醇、培美曲塞等需要用糖皮质激素来预防化疗不良反应,糖皮质激素减少组织对糖的利用和加速肝糖异生,使血糖升高。
3.2.4 靶向治疗相关性高血糖
3.2.4.1 胰岛素样生长因子(insulin-like growth factor,IGF)-1受体抑制剂
IGF信号转导通路在调节细胞生长、增殖、生存、运动、能量代谢和葡萄糖稳态中发挥重要作用。IGF家族包括3种配体(IGF-1、IGF-2和胰岛素)、3种受体[IGF-1受体(IGF-1 receptor,IGF-1R)、IGF-2受体(IGF-2 receptor,IGF-2R)] 和IR和6种IGF结合蛋白(IGF binding protein,IGFBP)。IGF-1R抑制剂在糖尿病发病机制中的作用较复杂,在糖尿病前期,骨骼肌和脂肪组织中IGF-1R信号转导通路的中断将导致胰岛素抵抗,发展为糖尿病[6]。IGF-1R和IR存在受体同源性,IGF-1R抑制剂在一定程度上抑制IR信号转导。IGF-1R抑制剂可促进垂体释放生长激素,促进胰岛素抵抗和糖异生,导致血糖升高[7]。目前针对IGF-1R的单克隆抗体包括dalotuzumab和cixutumumab,figitumumab、ganitumab和R1507的临床开发已中止,其他小分子IGF-1R抑制剂有linsitinib和ganetespib。因此,高血糖经常被列为以上药物的最常见不良反应[7]。
3.2.4.2 磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(phosphoinositide 3-kinase/protein kinase B/mammalian target of rapamycin,PI3K/Akt/ mTOR)信号转导通路抑制剂
PI3K/Akt/mTOR信号转导通路在正常细胞生长发育、维持器官稳态和功能方面发挥重要作用。PI3K/Akt/mTOR信号转导通路的异常激活与肿瘤发生、发展相关,因此该信号转导通路成为肿瘤治疗的重要靶点。PI3K/Akt/mTOR通路处于IR和胰岛素受体底物(insulin receptor substrate,IRS)蛋白的下游,作为关键效应因子参与胰岛素代谢。IRS激活后,PI3K/Akt/mTOR通路调控一系列下游信号,激活糖原合酶激酶3β和FoxO1蛋白,它们分别增加糖原的合成,抑制糖异生,从而降低血糖水平。因此,抑制该信号转导通路可导致高血糖[8]。
靶向PI3K/Akt/mTOR通路抑制剂主要分5类,分别为广谱PI3K抑制剂、PI3K/mTOR双重抑制剂、PI3K特异性亚基抑制剂、Akt抑制剂和mTOR抑制剂。目前已获得美国食品药品管理局(Food And Drug Administration,FDA)批准的药物包括一种广谱PI3K抑制剂(copanlisib)、一种PI3Kδ抑制剂(idelalisib)及三种mTOR抑制剂(西罗莫司、替西罗莫司和依维莫司)。PI3K/Akt/mTOR通路抑制剂相关不良反应包括高血糖、高脂血症、骨髓抑制、肺炎、口腔炎和肝毒性,最常见的剂量相关性不良反应为高血糖[8]。
⑴ PI3K抑制剂:PI3K分为3类。Ⅰ类PI3K分为ⅠA和ⅠB类。ⅠA类由PI3Kα、PI3Kβ和PI3Kδ组成,分别由PIK3CA、PIK3CB和PIK3CD基因编码。ⅠB类只有一个PI3Kγ亚基组成,由PIK3CG基因编码。PI3Kα介导代谢和胰岛素信号转导通路,PI3Kβ在血小板功能和血栓形成中发挥重要作用,PI3Kδ和PI3Kγ主要在免疫细胞中表达,在免疫系统中发挥重要作用。PI3K抑制剂可阻止脂肪细胞和心肌细胞中胰岛素介导的葡萄糖摄取,引起高血糖。PI3K抑制剂诱导的高血糖具有亚基特异性,PI3Kα是参与脂肪细胞和肌管中胰岛素应答的主要亚基,因此,抑制PI3Kα亚基可阻断胰岛素依赖性的葡萄糖摄取和脂肪细胞代谢,而阻断PI3Kβ、PI3Kδ和PI3Kγ亚基均未出现高血糖[8]。
⑵ Akt抑制剂:Akt激酶是体内调控葡萄糖转运的重要分子,主要包括3种亚型:Akt1、Akt2和Akt3。Akt1于细胞中广泛表达,Akt2主要表达于胰岛素敏感组织中,如骨骼肌、脂肪组织和肝脏,Akt3表达于睾丸和脑组织中[9]。激活Akt2可促进葡萄糖转运体-4(glucose transporter-4,GLUT-4)的翻译,调控GLUT-4转运至细胞膜,促进葡萄糖摄取,影响血糖转运。在细胞内Akt刺激已糖激酶将葡萄糖转为葡萄糖-6- 磷酸, 激活糖原合酶3(glycogen synthase kinase 3,GSK3),促进糖酵解和糖原合成。一方面,Akt抑制剂可抑制Akt激酶活性和GLUT-4,从而抑制葡萄糖摄取;另一方面,Akt抑制剂通过抑制GSK3抑制糖原合成,使血糖升高[9]。
⑶ mTOR抑制剂:mTOR为丝氨酸/苏氨酸蛋白激酶,属于PI3K相关激酶家族,在调节细胞生长和糖脂代谢中发挥重要作用。mTOR复合物包括mTORC1和mTORC2。mTORC1通过促进IRS-1的丝氨酸磷酸化来促进脂肪组织、骨骼肌和肝脏中的胰岛素抵抗,从而破坏PI3K的招募和激活,降低胰岛素活性。mTORC1是胰岛β细胞的正向调节因子,β细胞中mTORC1组成性激活可促进胰岛素分泌降低血糖。mTOR抑制剂主要抑制mTORC1,通过减少细胞内胰岛素信号转导通路,增加胰岛素抵抗,并且直接影响胰岛β细胞减少胰岛素分泌,影响糖代谢[10], 同时抑制mTORC1后还会出现β细胞成熟分化状态的倒退,甚至向α细胞分化,导致糖尿病的发生[11]。mTOR抑制剂对葡萄糖的代谢具有“双面效应”,过少或过多的mTORC1活性对糖脂代谢都不利。一方面,mTOR抑制剂(雷帕霉素)可降低胰岛素敏感性,同时降低Akt激酶磷酸化,降低GSK3的活性,导致糖原合成减少;另一方面,mTOR抑制剂(雷帕霉素)可增加JNK2/3激酶磷酸化,诱导胰岛素抵抗。雷帕霉素可破坏mTORC2复合物,阻断其对糖异生的抑制活性[12]。
3.3 肿瘤合并糖尿病或高血糖
肿瘤合并糖尿病或高血糖指发生肿瘤之前就已诊断为糖尿病或高血糖。在中国人群中,2型糖尿病患者中23种常见类型患癌风险均明显升高,男性患前列腺癌、血液系统恶性肿瘤、皮肤癌、甲状腺癌、肾癌、肝癌、胰腺癌、肺癌、结直肠癌和胃癌的风险升高,女性患鼻咽癌、肝癌、食管癌、甲状腺癌、肺癌、胰腺癌、淋巴瘤/白血病、子宫体癌、结直肠癌、乳腺癌、子宫颈癌和胃癌的风险升高[13-14]。同时,高血糖状态也会增加糖尿病前期患者的患癌风险,其中空腹血糖(fasting plasma glucose,FPG)受损的患者(6.1~7.0 mmol/L)还会导致癌症死亡率增加[15-16]。因此,癌症的发生和预后与糖尿病甚至糖尿病前期(糖耐量受损或FPG受损)密切相关。
3.4 肿瘤和血糖关系密切的信号转导通路
高血糖、慢性炎症、肥胖等因素可诱发靶组织(肝脏、骨骼肌、脂肪)发生胰岛素抵抗或胰岛素作用受损。当发生胰岛素抵抗时,胰岛β细胞会分泌更多胰岛素来克服这种情况。当β细胞不能补偿这种压力时,细胞开始凋亡,导致胰岛素合成和分泌减少,使血糖逐渐升高发展为糖尿病。慢性高血糖介导不可逆的细胞损伤,称为葡萄糖毒性。高血糖是心血管疾病、细胞增殖和癌细胞进展的激活因子,可促进活性氧(reactive oxygen species,ROS)的产生和DNA损伤,在炎症反应中起重要作用。葡萄糖毒性的发生机制包括增强氧化应激、刺激多元醇途径、蛋白激酶C(protein kinase C,PKC)激活、晚期糖基化终末产物(advanced glycation end product,AGE)形成和基因表达改变。胰岛素抵抗、高胰岛素血症及所致的糖尿病也是癌症的危险因素,与肿瘤具有显著相关性,且与肿瘤的不良预后密切相关[17]。虽然糖尿病与恶性肿瘤之间相互影响的分子生物学机制尚未完全阐明,但已有大量的研究证实,胰岛素/IGF轴与恶性肿瘤发病风险或预后之间有密切联系。胰岛素/IGF轴激活多种代谢和有丝分裂信号转导通路,促进细胞异常增殖、侵袭、迁移和抑制细胞凋亡等,也是恶性肿瘤发生、发展的基础[18-19]。
IGF-1、IGF-2和胰岛素与细胞表面跨膜受体IGF-1R、IGF-2R和IR结合并诱导其作用,IRS的酪氨酸残基磷酸化,激活癌症和糖尿病中常见的两条信号转导通路:PI3K/Akt/mTOR和Ras/Raf/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/ERK信号通路。IRS-1表达于各种组织细胞中,主要是骨骼肌细胞,也是IGF-1R的底物,主要影响细胞生长。IRS-2也表达于各种组织细胞中,在肝脏和胰岛β细胞中大量表达,主要影响肝脏的代谢功能和胰岛β细胞的生长和分化。IRS-1和IRS-2是胰岛素和依赖IGF的有丝分裂和代谢调控的关键介质。IRS-1的磷酸化激活PI3K/Akt/mTOR信号转导通路,促进细胞异常增殖、存活并抑制细胞凋亡。SHC的激活通过Ras/Raf/MAPK信号转导通路促进细胞增殖和基因转录[6,20-21]。
此外,由癌基因介导细胞代谢的改变可以导致恶性细胞产生代谢废物,引发内质网应激,促进肿瘤微环境中免疫细胞的炎症反应,炎症信号分子(如IL-6)可以逃逸到体循环中,通过经典的IL-6Rα/gp130/pSTAT3信号转导通路在肝脏中发挥作用,促进STAT3靶基因细胞因子信号转导抑制因子3(suppressor of cytokine signaling 3,SOCS3)的转录,破坏IRS-1和破坏IRS-2,导致葡萄糖摄取不足和高血糖[22]。
3.5 肿瘤相关性高血糖的诊断与鉴别诊断
3.5.1 诊断
3.5.1.1 病史及临床表现
① 发现肿瘤前,未报告有高血糖或糖尿病病史,发现肿瘤后或接受抗肿瘤治疗后出现非一过性血糖升高;② 肿瘤部位及性质与高血糖密切相关,如胰岛细胞癌、肺癌、嗜铬细胞瘤、神经内分泌瘤等肿瘤;③ 使用有血糖增高风险的抗肿瘤治疗,伴有肝肾功能损伤、胰岛β细胞损伤等;④ 使用糖皮质激素等可能引起血糖升高的化疗辅助用药。
3.5.1.2 诊断标准
目前尚无统一标准来诊断肿瘤相关性高血糖和糖尿病,可参考世界卫生组织(World Health Organization,WHO)于1999年公布的糖尿病诊断标准[23]。WHO 1999年标准与1997年美国糖尿病协会的诊断标准相同[23]。肿瘤相关性
高血糖:随机血糖水平>7.8 mmol/L或FPG>6.1 mmol/L。随机血糖:不考虑上次进食时间的任一时相血糖。空腹:禁热量摄入至少8 h。
肿瘤相关性糖尿病:典型的糖尿病症状(烦渴多饮、多尿、多食、不明原因的体重下降)合并随机静脉血浆葡萄糖≥11.1 mmol/L或FPG≥7.0 mmol/L或口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)的2 h静脉血浆葡萄糖≥11.1 mmol/L。无典型症状,需改天复查确认。
3.5.2 鉴别诊断
3.5.2.1 应激性糖尿病
出现脑出血、麻醉、大量消化道出血、骨折、手术等应激情况时,血糖呈暂时性升高,部分甚至发展成糖尿病,可于随访中加以鉴别。
3.5.2.2 其他因素引起的高血糖
除肿瘤、抗肿瘤治疗之外的其他因素也可能会导致血糖升高,如高糖饮食、药物损伤、肝功能异常、胰腺损伤、类固醇性高血糖等。可通过调查饮食习惯、药物使用情况来排除生活习惯和药物性因素的影响,可通过实验室检查排查胰腺病变、肝硬化、肝炎等引起的高血糖。类固醇性高血糖/糖尿病还可能伴有满月脸、向心性肥胖、高血压等症状。
要点提示:
⑴ 中国恶性肿瘤和糖尿病发病率呈逐年上升趋势。
⑵ 恶性肿瘤与高血糖和糖尿病关系密切,高血糖和糖尿病可导致多种恶性肿瘤的发病率上升。
⑶ 部分恶性肿瘤可导致高血糖和(或)糖尿病。
⑷ 恶性肿瘤治疗过程中可出现高血糖和(或)糖尿病。
⑸ 高血糖和(或)糖尿病会使恶性肿瘤患者的预后更差。
4肿瘤相关性高血糖的管理
癌症患者合并糖尿病可能对死亡率和预后有着深远影响,糖尿病会使癌症患者的全因死亡率和癌症特异性死亡率增加30%~50%[1-3],这可能是由于糖尿病影响手术或化疗效果。事实上,糖尿病患者的术后死亡率和癌症发病率显著增加;与接受癌症手术治疗的非糖尿病患者相比,接受癌症手术治疗的糖尿病患者的术后死亡率增加1.5倍[4]。血糖控制不好会影响癌症的治疗效果[5-6],并且血糖控制与糖尿病合并癌症患者的预后呈正相关[7-8]。高血糖会加剧术后或化疗后的感染风险,还可能导致营养状况恶化,所有这些都会影响癌症患者的预后[9]。此外,血糖控制也与糖尿病患者疼痛的严重程度相关,血糖控制不良患者的疲劳程度通常也更严重[10]。
癌症治疗过程中的高血糖管理具有挑战性,许多糖尿病患者及其临床医师可能会忽视高血糖。令人担忧的是,糖尿病患者确诊癌症后,会降低对糖尿病的关注度而对降血糖药的依从性较差[11],这种做法需要纠正,因为血糖控制不好,癌症治疗(如手术)的预后会更差。随着治疗技术的提高,许多患者可以在癌症治疗后获得相对正常的寿命,但这可能会受癌症治疗过程中所导致或恶化的高血糖影响。合并糖尿病的癌症患者及其临床医师需要注意“与癌症共存并超越癌症”,癌症患者存活率日益增长可能受益于糖尿病的良好管理[12-15]。因此,高血糖合并癌症的患者需要控制好血糖。
欧美糖尿病指南强调控制血糖个体化目标的必要性,包括评估对象的年龄、共病和参与血糖控制的意愿[16-17]。在癌症患者中,虽然没有随机试验证据表明严格控制血糖可以改善预后,然而,在缺乏此类证据的情况下,需要根据患者的具体情况对控制血糖目标进行个体化设定。决定控制血糖目标时要考虑的因素包括患者自身的偏好、年龄、共病(如肾、心或肝功能不全)、预后和预期寿命。因此,对于预后良好的患者,无论是为了预防癌症治疗的急性并发症(如外科感染),还是为了预防糖尿病的长期并发症,都有必要设定更严格的血糖控制目标。在预后更差的人群中,严格的控制血糖指标可能与临床预后关系不大。总之,糖尿病合并癌症患者的血糖控制应个性化,应与患者共同讨论控制血糖的风险和益处。
4.1 肿瘤相关性高血糖的评估和控制目标
4.1.1 肿瘤相关性高血糖的评估
肿瘤相关性高血糖是指由肿瘤本身或肿瘤治疗过程中导致的高血糖以及肿瘤患者合并已知的糖尿病状态,即FPG>6.1 mmol/L,随机血糖水平>7.8 mmol/L,动态监测血糖水平若明显高于此水平,提示可能需要治疗,并建议观察HbA1c变化。既往无糖尿病史患者,HbA1c≥6.5%,提示已存在高糖状态,考虑为新诊断糖尿病;而应激性高血糖患者的HbA1c水平一般不高,血糖水平通常随导致血糖升高的各种因素的出现或缓解而升高或恢复正常。
床旁血糖检测:住院糖尿病患者进食时,应在餐前进行床旁血糖检测;不进食者,建议每4~6 h进行1次血糖监测[18]。胰岛素静脉给药时,为保证安全,需要更频繁地进行床旁血糖检测,推荐每30~120 min监测1次,禁止共用手术刀片、测试材料和针头[19]。绝大多数医院的血糖监测是使用标准血糖监测仪采集的手指毛细血管血进行检测的[20]。床旁血糖检测不如实验室血糖检测结果精确,由于受灌注、水肿、贫血、红细胞增多和医院常用药物的影响,毛细血管血糖读数容易出现误差,需要注意质控。
血糖的控制情况可以通过HbA1c、糖化白蛋白、持续血糖监测(continuous glucose monitoring,CGM)和自我血糖监测(self- monitoring of blood glucose,SMBG)进行评估。HbA1c是迄今为止通过临床试验证明能够衡量血糖控制的指标,可反映取血前8~12周的平均血糖水平,糖化白蛋白则可反映近2~3周的血糖水平。患者SMBG可用于自我管理和药物调整,特别是在个人使用胰岛素期间。相较于单次血糖测定,1天内多次血糖测定可更准确地反映血糖控制情况。建议患者每周2天测定三餐前后及睡前的血糖,如怀疑有夜间低血糖,应加测凌晨时段的血糖。CGM通过持续监测可了解一段时间内血糖变化趋势以及单日内血糖的波动幅度,在评估1型糖尿病的肿瘤患者和血糖波动较大、难以控制、低血糖风险高的肿瘤患者治疗的有效性和安全性方面具有重要的作用。尽管CGM在检测和降低低血糖发生率方面比床旁血糖检测具有一定优势,但CGM还没有被批准替代床旁血糖检测用于住院患者,而且该技术的推广依赖于患者和血糖管理团队都受过良好的糖尿病学教育。
最近研究显示,仅使用HbA1c评估血糖变化水平很可能有误导性[21-22]。随着CGM技术的发展,其设备的精确度和实用性均有显著提高,葡萄糖目标范围内时间(time in range,TIR)是新的评估血糖控制情况的实用指标,它与HbA1c有很好的相关性,TIR控制目标70%与HbA1c控制目标7%相对应[23-28]。因此,建议将动态葡萄糖图谱(ambulatory glucose profile,AGP)和TIR用于评估血糖管理。对于无严重低血糖的非妊娠成年肿瘤患者的血糖控制目标分为两部分:① 建议HbA1c<7%;② 若使用AGP/葡萄糖管理指标(glucose management indicator,GMI)评估血糖管理,则与HbA1c目标对应的推荐控制目标为TIR>70%且葡萄糖低于目标范围时间(time below range,TBR)<4%。
无论高血糖的发病原因如何,也无论患者是否伴发糖尿病,高血糖本身均可增加患者的并发症和死亡风险。因此,发现肿瘤相关性高血糖的同时还应进行病情评估,包括年龄、预期寿命、是否存在器官功能不全、精神或智力障碍、心脑血管疾病既往史和(或)风险程度、是否需要住院、是否需要重症监护、是否需进行手术、手术类型(急症、择期、整形等精细手术或器官移植手术)、营养状态、进食情况(禁食、正常摄食或胃肠外营养)等。
肿瘤治疗(如放化疗、靶向治疗、应用糖皮质激素、免疫治疗、手术等)过程中出现或伴随的应激事件可能会恶化血糖控制,导致酮症酸中毒或非酮症性高血糖高渗状态,危及生命,需要立即就医以防止高血糖危象和死亡。任何导致血糖控制恶化的情况都需要增加监测血糖的频率;容易发生酮症的患者也需要进行尿酮或血酮监测。如果发生显著的高血糖并伴有酮症、呕吐或意识水平改变,需要临时调整治疗方案,并立即与糖尿病护理团队进行沟通。接受非胰岛素治疗或单用药物营养治疗的患者可能需要胰岛素,同时必须确保充足的液体和热量摄入,如伴发感染或脱水则需要住院治疗。
推荐:
⑴ 对于达到治疗目标、血糖控制稳定的患者,每年至少评估2次血糖状态(HbA1c或其他血糖测量方式)。E级
⑵ 对于最近改变和(或)未达到血糖目标的肿瘤合并高血糖患者,至少每季度评估1次血糖状况,并根据需要进行评估。E级
⑶ 葡萄糖TIR与微血管并发症密切相关,应作为血糖控制情况的重要评估指标,TBR(糖尿病患者血糖水平<3.9 mmol/L,非糖尿患者血糖水平<3.0 mmol/L)和高于目标范围时间(time above range,TAR)(血糖水平>10.0 mmol/L)是重新调整治疗方案的依据。C级
⑷ 有糖尿病史的肿瘤患者,既往3个月内如未进行HbA1c检测,则需进行HbA1c检测;有糖尿病史的患者还应询问既往有无低血糖事件,评判发生低血糖的风险程度。B级
⑸ 当使用CGM时,需要保证有糖尿病教育、培训支持和背景,以实现最佳的CGM使用效率和依从性。使用CGM设备的患者需要有能力进行SMBG,以便随时矫正他们的监视器和(或)验证读数是否与他们的症状不一致。B类
⑹ 实时CGM结合每天多次注射、持续皮下胰岛素输注和其他形式的胰岛素治疗可降低和(或)维持中青年糖尿病患者HbA1c水平和(或)降低血糖。A级
⑺ 扫描式CGM结合每天多次注射、持续皮下胰岛素输注和其他形式的胰岛素治疗可降低中青年糖尿病患者的HbA1c水平,降低低血糖发生率,可取代SMBG。B级
⑻ 对于每天多次注射和持续皮下胰岛素输注的患者,应尽可能使用实时CGM设备,以获得最大效益。应至少每8 h使用间断性扫描的CGM设备扫描1次。A级
⑼ 作为餐前和餐后SMBG的辅助手段,CGM有助于实现妊娠期的HbA1c目标。B类
⑽ 使用专业的CGM和(或)实时或间歇扫描式CGM有助于识别和纠正高血糖和低血糖,并改善非胰岛素和基础胰岛素治疗糖尿病患者的HbA1c水平。C级
⑾ 应及时对使用过程中出现的皮肤刺激或过敏反应进行评估和处理。E级
4.1.2 肿瘤相关性高血糖的控制目标
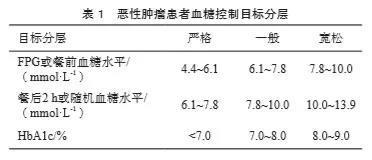
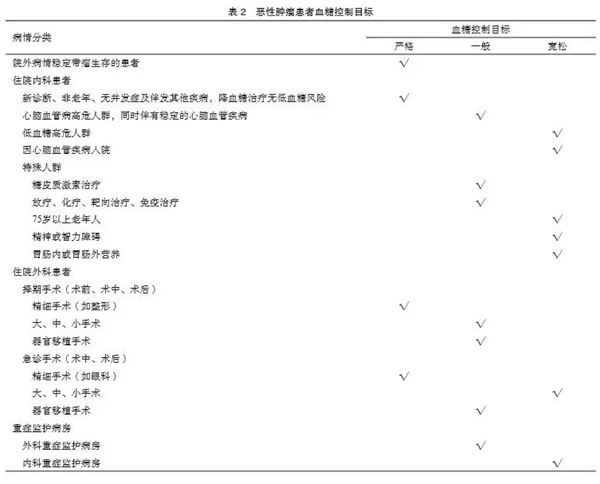
既往很少有指南对肿瘤相关性高血糖提出明确的控制目标,而对于大部分肿瘤相关性高血糖患者的血糖管理,部分学者倾向于宽松的控制目标,但不适用于院外病情稳定、长期带瘤生存的患者,也不适用于住院的肿瘤相关性高血糖患者的个体化控制,例如,根据不同手术类型、放化疗、重症监护病房等情况制定个体化的控制目标。随着肿瘤发生率的不断攀升以及现代医疗手段的不断进步,越来越多的肿瘤患者预期寿命不断延长,远超5年,因此对于血糖的控制应该更加细化,设定血糖目标时必须考虑许多因素。目前,研究者们已意识到制定基于患者特征的个体化目标的重要性,血糖目标必须在共享决策的背景下进行个性化调整,以满足每例患者的需求和偏好,综合平衡治疗风险和益处,从而优化患者恶性肿瘤患者的实际情况,沿用既往指南中患者血糖控制目标分层(表1),并根据具体的肿瘤患者院内外血糖值和内外科诊断、治疗情况制定血糖控制目标(表2)。调整目标的原则:如果在可接受治疗方案下安全地达到更严格的目标,并且预期寿命足以从严格的目标中获益,则可以推荐更严格的目标;如强化目标所带来的益处会导致患者的预期寿命无法实现,若风险和负担超过潜在益处,则建议设定宽松的目标。严重或频繁的低血糖是改变治疗方案的绝对指征,包括设定更宽松的血糖控制目标。
推荐:
⑴ 绝大部分非妊娠肿瘤合并糖尿病患者HbA1c目标为7%,无明显低血糖。A级
⑵ 如果使用动态血糖曲线来评估,则大部分肿瘤合并糖尿病患者需要>70%的葡萄糖TIR,低于4%的葡萄糖未达到TIR。B级
⑶ 根据医务人员的判断和患者偏好,如果能够安全地达到相应的HbA1c目标水平而不发生严重低血糖或其他治疗不良反应,则HbA1c水平低于7%的目标是可以接受的,甚至是有益的。C级
⑷ 宽松的HbA1c目标(如<8%)适用于预期寿命有限或治疗危害大于益处的肿瘤合并糖尿病患者。B级
⑸ 胰岛素治疗应以血糖10.0 mmol/L开始,用于治疗持续性高血糖症。一旦开始胰岛素治疗,对于大多数肿瘤合并高血糖患者,建议目标血糖范围为7.8~10.0 mmol/L。A级
⑹ 严格的控制目标为6.1~7.8 mmol/L,适合部分无明显低血糖危险因素且预期寿命超过5年的患者。C级
4.1.3 肿瘤相关性高血糖的住院控制
4.1.3.1 入住院前的准备
为保证肿瘤合并高血糖患者的住院质量,最好使用结构化的护理医嘱和流程,其中包括计算机化的医嘱输入(computerized physician order entry,CPOE)。如果在入院前3个月[29-32]内没有检测血糖和HbA1c,则应检测患者的HbA1c。此外,入院时应评估糖尿病自我管理知识和行为,并酌情提供糖尿病自我管理教育。糖尿病自我管理教育应包括出院后所需的适当技能,如药物剂量、给药方式、血糖监测、低血糖的识别和治疗[33-34]。对于择期手术肿瘤患者在入院前预先控制好高血糖,这是减少不良反应的有效手段[35-38]。建议使用CPOE以防止药物相关性错误,提高药物管理的效率[39]。由于使用CPOE可以显著改善血糖TIR百分比,降低平均血糖水平,且不增加低血糖的发生率[40]。因此,在可行的情况下,应该为血糖控制提供CPOE建议。电子胰岛素医嘱模板也能改善2型糖尿病患者的平均血糖水平而不增加低血糖的发生率,因此结构化胰岛素医嘱集应纳入CPOE[41-42]。
4.1.3.2 住院患者(内分泌科及非内分泌科)肿瘤相关性高血糖的管理
住院患者的高血糖定义为血糖水平>7.8 mmol/L[33-34,43]。血糖水平持续高于这一水平应干预,如改变饮食或改变导致高血糖的药物。入院HbA1c值为6.5%表明糖尿病的发病先于住院治疗。住院患者的低血糖血症按血糖浓度和临床相关性分类[44]:1级低血糖是指血糖浓度为3.0~3.9 mmol/L;2级低血糖是指血糖浓度为3.0 mmol/L,通常导致低血糖的中枢神经系统症状;3级低血糖是已出现以精神和(或)身体功能改变为特征的临床事件,需要对症治疗才能康复。2、3级低血糖需要立即纠正血糖。
对于接受连续外周或中心静脉营养的患者,可以向营养液中添加短效胰岛素,特别是在过去24 h内需要0.20个单位对抗胰岛素的情况下。建议每10 g葡萄糖添加1个单位人常规胰岛素的起始剂量[45],并应每天调整解决方案。肠外营养液中的胰岛素使用应根据肠外营养是否需要而随时调整,如果临时需要停止或中断肠外营养,那么在肠外营养袋中添加胰岛素而非预先皮下注射胰岛素是预防低血糖最安全的方法。同时,因为持续的肠内或肠外营养会导致血糖持续处于餐后状态,因此,在此期间最好将血糖水平保持在餐后正常的血糖水平(7.8 mmol/L左右)以防止低血糖。
经过培训的专家或专业团队可以缩短住院时间,改善血糖控制,改善预后[46-48]。由专门的糖尿病管理团队提供住院治疗服务,可降低因糖尿病住院后30 d再入院的风险,并节省成本[49-50]。在常规护理与专家管理下的横断面研究结果显示,专家仅通过电子病历审查病例并提出建议,通过电子“虚拟护理”,就可使得高血糖和低血糖的发生率降低30%~40%[51-52]。因此,应建立专业的糖尿病护理团队,并制定相应的工作手册[52-53]。
针对危重肿瘤患者的血糖管理尚存在争议,有学者认为,积极治疗对降低住院患者的血糖有立竿见影的效果,在危重患者中,强化静脉注射胰岛素方案使血糖达到4.4~6.1 mmol/L的目标范围,与标准的10.0~12.0 mmol/L的血糖范围相比,死亡率降低40%[54]。然而,部分专家认为,与较为适中的血糖指标相比,严格的血糖控制通常会导致低血糖症,增加危重患者死亡率,应该慎重考虑危重病患者降血糖的最佳目标范围[55]。
对于接受每天多次注射胰岛素的中青年肿瘤合并糖尿病患者,在能够安全管理胰岛素泵的前提下可以考虑使用胰岛素泵治疗。持续的胰岛素泵治疗也对老年人血糖控制较好且安全性高,应允许在老年肿瘤合并糖尿病患者中尽可能使用胰岛素泵治疗。糖尿病技术和在线培训相结合对于肿瘤合并糖尿病和高血糖的患者而言是有潜在获益的。使用CGM设备可减少医患之间直接接触,节省个人防护用品,提高患者的监测频率。因此,在有监督的情况下,应鼓励使用糖尿病移动设备的肿瘤患者住院时继续使用相关移动设备。
推荐:
⑴ 对所有入院前3个月未进行HbA1c测试的肿瘤合并糖尿病或高血糖患者(血糖>7.8 mmol/L)进行HbA1c检测。B级
⑵ 应根据血糖波动对胰岛素剂量进行结构化的合理调整。B级
⑶ 住院的肿瘤合并糖尿病患者应尽可能咨询专门的糖尿病或血糖管理团队。C级
4.1.3.3 胰岛素疗法
⑴ 重症监护病房:在危重患者中,持续静脉胰岛素输注是实现血糖目标的最有效方法。静脉胰岛素输注应根据经验或指南进行,可预先调整输注速率,根据血糖波动和胰岛素剂量调整,血糖控制标准见表2。
⑵ 非重症监护病房:在大多数情况下,胰岛素是住院患者高血糖的首选治疗方法。但在某些情况下如已换成口服降血糖药,可能转为门诊治疗更合适[56]。如果在医院内持续口服药物,应在出院前1~2 d制定恢复方案。住院患者的胰岛素笔应严格遵守仅供本人使用的原则。
在重症监护病房外,建议使用胰岛素方案来控制糖尿病患者的高血糖。使用胰岛素类似物和人胰岛素的方案有类似的血糖控制效果[57]。餐前皮下注射速效或短效胰岛素,如果不进食或患者正在接受持续的肠内或肠外营养,则每4~6 h注射1次,以纠正高血糖。基础胰岛素或基础+餐时方案是非危重病住院患者口服摄入不足或限制口服的首选治疗方案。应注意保证住院患者营养摄入良好,也可建议采用胰岛素泵治疗,使血糖控制更平稳。
对于正在进食的患者,胰岛素注射应与进餐保持一致。在这种情况下,床旁血糖检测应在餐前进行。如果进食摄入量很低,更安全的方法是在患者进食后立即注射餐时胰岛素,并根据摄入食量的大小调整剂量[57]。
虽然在门诊可使用预混胰岛素制剂,但不建议长期使用预混胰岛素方案作为高血糖住院患者的唯一治疗方法[58-60]。因为在接受预混胰岛素组中,虽然血糖控制差异无统计学意义,但低血糖发生率显著增加[61]。因此,预混胰岛素方案不常规推荐在住院期间使用。
当停止静脉注射胰岛素时,需要制定从静脉注射到皮下注射胰岛素的过渡方案[61-62]。具体方法为:已达到稳定的血糖目标时,患者应在停止静脉输注胰岛素2 h前接受皮下基础胰岛素剂量,基础胰岛素的剂量最好根据最后6 h的胰岛素输注率来计算[63]。对于这些患者来说,最重要的是配备专用注射工具及制定个性化的方案并确保依从性[64-65]。
住院期间非胰岛素降血糖疗法的安全性和有效性尚存在争议[66-67]。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)受体激动剂和二肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)抑制剂在住院患者中有效[68-71],但对于合并心力衰竭的患者应停用沙格列汀和阿格列汀[72]。钠-葡萄糖耦联转运体2(sodium-glucose linked transporter 2,SGLT2)抑制剂在合并酮尿症或酮症酸中毒患者,以及长期禁食和手术过程中应避免使用,在尿路感染或生殖器感染风险较高的人群中也应尽量避免使用,另外对于血容量不足的患者,使用SGLT2抑制剂治疗前应纠正[73]。在确定安全性和有效性之前,SGLT2抑制剂不建议常规在家使用。此外,SGLT2抑制剂应在计划手术前3 d停止使用(埃格列净为4 d)。胰岛素治疗住院期间可能会出现低血糖,虽然低血糖与死亡率增加有关[74],但在许多情况下,低血糖是潜在疾病的标志,而不是死亡的主要原因。然而,低血糖是代谢失调和(或)糖尿病治疗的严重后果,住院患者必须尽量避免低血糖。住院患者的许多低血糖发作是可以预防的,因此,医院应该采用和实施低血糖预防和管理方案。应制定一个标准化的由护士发起的低血糖治疗方案和流程,以立即解决血糖水平<3.9 mmol/L的情况。此外,还应为每例患者制定预防和治疗低血糖的个体化计划,发生在医院里的低血糖事件应记录在病历中并进行随访。
推荐:
⑴ 对于持续性高血糖,应开始胰岛素治疗,血糖起始值为10.0 mmol/L。一旦开始胰岛素治疗,建议大多数危重病和非危重病患者的目标血糖范围为7.8~10.0 mmol/L。A级
⑵ 更严格的目标如6.1~7.8 mmol/L,如果能够在无明显低血糖的情况下实现,则可能适用于部分预后较好的患者。C级
⑶ 基础胰岛素或基础+餐时胰岛素方案是非危重病住院患者的首选治疗方案,适用于禁食或进食量不稳定的患者。A级
⑷ 对于营养摄入良好的非危重病住院患者,预混胰岛素方案是首选治疗方案。A级
⑸ 不鼓励在住院患者中仅使用临时非恒定的胰岛素方案。A级
⑹ 医院系统应预先制定好低血糖防范方案,为每例患者制定预防和治疗低血糖的计划。发生在医院里的低血糖事件应记录在病历中并进行随访。E级
⑺ 当记录到血糖水平为3.9 mmol/L及以下时,应对治疗方案进行审查并根据需要进行调整,以防止低血糖加重。C级
4.1.4 肿瘤患者特殊情况下的血糖管理
4.1.4.1 围手术期管理
肿瘤患者围手术期的血糖控制标准缺乏可靠的证据基础。但可以参考以下措施[75-78]:① 根据成人围手术期血糖监测专家共识,成人围手术期糖尿病患者血糖控制目标分为宽松标准、一般标准和严格标准,并建议普通手术采用宽松标准,器官移植手术、身体状况良好、无脑心血管并发症风险的非老年患者或单纯应激性高血糖采用一般标准。② 术前对缺血性心脏病高危的糖尿病患者和有自主神经病变或肾功能衰竭的患者应进行风险评估。③ 在没有麻醉风险的情况下二甲双胍应在手术当天保留,此外,二甲双胍有引起乳酸酸中毒的风险,肾功能不全者术前应停用24~48 h。④ SGLT2抑制剂必须在手术前3~4 d停用。⑤ 在手术当天早晨停用任何其他口服葡萄糖制剂,给予一半剂量的中效胰岛素或75%~80%剂量的长效类似物或泵注基础胰岛素,长时间大手术、术后无法恢复进食的糖尿病患者,手术日换用短效胰岛素持续静脉泵注以控制血糖。短小门诊手术者,手术当天可保留中长效胰岛素,剂量不变或减少1/3~1/2,停用餐前短效胰岛素。⑥ 至少每2~4 h检测1次血糖,同时患者不口服任何药物,并根据需要使用短效或速效胰岛素。⑦ 目前还没有关于围手术期中GLP-1受体激动剂或超长效胰岛素类似物的使用和(或)对血糖影响的研究数据。⑧ 避免术前不必要的长时间禁食,糖尿病患者择期手术应安排在当天第1台进行。
由于围手术期血糖水平控制在4.4~10.0 mmol/L并不能改善预后,而且增加低血糖的发生率[76]。因此,不建议采用更严格的血糖控制指标。与常规剂量相比,术前最后1次给予的胰岛素减少25%更有可能使围手术期血糖水平保持在目标范围内,低血糖风险较低[79]。基础胰岛素加餐前短效或速效胰岛素(基础联合餐时)方案与多次短效胰岛素注射方案相比,可改善血糖控制效果并降低围手术期并发症的发生率[80-81]。
4.1.4.2 肠内或肠外营养
接受癌症治疗的患者经常需要肠内或肠外营养。高血糖症在采用这种营养方案的人群中很常见,建议肠内营养患者的目标血糖范围设定为6~12 mmol/L,为避免低血糖,可接受较为宽松的血糖控制范围。二甲双胍粉可显著改善血糖控制效果,低血糖风险较低,可通过喂食管给药。也建议在喂养的起点和中间使用预混或基础胰岛素[82]。
肠内营养患者发生低血糖可能导致严重后果,特别是如果他们的意识水平降低时低血糖不易被发现,因此建议加强血糖监测频率。若出现低血糖建议通过喂食管快速给予15~20 g碳水化合物,或肌肉内注射胰高血糖素或口服葡萄糖凝胶(如果吞咽反射完整),不建议使用磺脲类药物(sulfonylurea,SU)。
对于需要胰岛素的肠内或肠外营养患者,治疗方案应包括基础、膳食和矫正需求[82-83]。尤其重要的是,1型糖尿病患者即使停止进食,也要继续接受基础胰岛素治疗。大多数接受基础胰岛素治疗的患者应继续使用其基础剂量,而每天营养液中的胰岛素剂量可计算为配方奶粉中每10~15 g碳水化合物配方1个单位胰岛素[84]。大多数专家建议每天使用2~3次中效胰岛素(每8或12 h使用1次),以满足患者的需要。根据血糖情况调整胰岛素剂量。使用人常规胰岛素或普通胰岛素应每6 h皮下注射1次,对于接受肠内导管喂食的患者,每次喂食前应根据每10~15 g碳水化合物换算约1个单位的常规人胰岛素或速效胰岛素比例皮下注射。正确的餐前胰岛素用法应在每次喂养前注射。在接受夜间管饲的患者中,开始喂食时给予基础胰岛素较为合理。
4.1.4.3 DKA与高渗性高血糖状态
DKA与高渗性高血糖状态的表现有相当大的差异,可从正常血糖或轻度高血糖和酮症酸中毒到严重高血糖、脱水和昏迷;因此,需要根据仔细的临床和实验室评估进行个体化治疗[85-88]。
管理目标包括恢复循环血容量和组织灌注,解决高血糖,纠正电解质失衡和酸中毒。治疗败血症、心肌梗死或中风的任何可纠正的潜在原因也很重要。对于患有DKA或高渗性高血糖症的危重患者和精神迟钝患者,推荐持续静脉注射胰岛素。
将患者从静脉注射胰岛素过渡到皮下注射胰岛素需要在停止静脉注射胰岛素前2~4 h给予基础胰岛素,以防止再发酮症酸中毒和反跳性高血糖[87]。无并发症的DKA患者有时可在急诊室或抢救室使用皮下注射胰岛素治疗,这种方法可能比静脉注射胰岛素更安全、更具成本效益[89]。如果使用皮下注射胰岛素,最重要的是要提供足够的补液和频繁的床旁血糖检测。对任何并发感染的患者给予治疗的同时应进行适当随访,以避免复发性DKA。在DKA患者中过早使用碳酸氢盐对酸中毒的缓解或出院时间没有显著影响,因此一般不建议使用碳酸氢盐[33]。
4.1.4.4 妊娠合并高血糖或糖尿病
一旦诊断妊娠合并高血糖或糖尿病后,治疗从药物营养治疗、体育锻炼和体重管理开始,所有妊娠合并高血糖或糖尿病的患者均应自我监测FPG和餐后血糖以达到最佳的血糖水平。血糖控制目标范围应为:① FPG为3.9~5.3 mmol/L;② 餐后1 h血糖为6.1~7.8 mmol/L或餐后2 h血糖为5.6~6.7 mmol/L。需要注意的是,该下限目标并不适用于饮食控制的妊娠合并2型糖尿病患者[90]。
除餐前和餐后SMBG外,CGM有助于妊娠合并糖尿病患者HbA1c达标,并且可以降低大于胎龄妊娠和新生儿低血糖的发生率。建议肿瘤合并糖尿病的女性患者孕期TIR控制目标为:① TIR(3.5~7.8 mmol/L)>70%;② TBR(<3.5 mmol/L)<4%;③ TBR(<3.0 mmol/L)<1%;④ TAR(>7.8 mmol/L)<25%。虽然TIR可用于评估血糖控制效果,但其并不反映空腹、餐后低血糖或高血糖的信息。因此,CGM指标可作为辅助手段,但不可替代空腹和餐后SMBG[91]。
胰岛素仍是妊娠合并糖尿病患者首选的降血糖药,每天多次注射胰岛素或胰岛素泵均可用于妊娠合并糖尿病的肿瘤患者,但目前仍不明确胰岛素泵治疗是否优于每天多次注射胰岛素。同时,最新的证据表明,能满足妊娠期FPG和餐后血糖目标达成的混合闭环胰岛素泵可以降低低血糖的发生率,并可通过使用更多餐前大剂量胰岛素以达到控制目标,然而并非所有混合闭环胰岛素泵都能达到孕期血糖控制目标的要求。
对于合并慢性高血压的糖尿病孕妇,建议将血压目标定为(110~135)/85 mmHg,以同时降低孕妇高血压失控和胎儿生长受限的风险。建议肿瘤合并糖尿病的女性患者应从妊娠12~16周开始每天服用100~150 mg的小剂量阿司匹林,以降低子痫前期的发生风险。但目前尚无充分证据证明阿司匹林对妊娠前已确诊糖尿病的女性患者有益[90]。
推荐:
⑴ 生活方式、行为改变是妊娠期糖尿病管理的一个重要组成部分,可能用于大部分妇女。如果需要进一步实现血糖达标,应添加胰岛素。A级
⑵ 胰岛素是治疗妊娠期糖尿病、高血糖症的首选药物。二甲双胍和格列本脲不应作为一线药物使用。其他口服和非胰岛素注射降血糖药缺乏长期的安全性数据。B级
⑶ 二甲双胍用于治疗多囊卵巢综合征和诱导排卵时,应在妊娠早期终止。A级
4.1.4.5 糖皮质激素的使用
糖皮质激素在癌症化疗中有许多作用,有证据表明,少量多次使用糖皮质激素或延长静脉注射时间,可能会稍微减轻其导致高血糖的效应[63]。根据其使用情况,癌症患者服用糖皮质激素的剂量可能会有很大差异。例如,止吐方案可在化疗前静脉注射地塞米松20 mg,化疗后2~3 d每天8 mg,而在多发性骨髓瘤患者中,可使用剂量高达40 mg/d,持续8周[92]。糖皮质激素引起的高血糖发生与治疗时间、疗效及剂量有关。在一项对11 000多例接受糖皮质激素治疗的患者进行的回顾性研究[93]中,与对照组相比,每天接受等量50、100和>120 mg氢化可的松治疗的患者患糖尿病的比值比分别为3.02、5.82和10.35。大剂量糖皮质激素通过增加肝脏糖异生、增加胰岛素抵抗和减少胰岛素分泌来升高血糖。因此, 糖皮质激素引起的高血糖是典型的餐后血糖增高,但往往在禁食后恢复正常。因此,在没有已知既往糖尿病的人群中,应在午餐或晚餐前,或午餐或晚餐后使用毛细血管葡萄糖检测来随访。对于既往未知是否有高血糖的患者,在化疗前检查HbA1c也很重要,以确定是否有未确诊的糖尿病。由于类固醇类药物诱导的糖尿病是之后糖尿病发展的一个危险因素[66],因此在停止使用类固醇类药物后,应常规进行HbA1c监测(至少每年1次),以明确是否有糖尿病。鉴于糖尿病患者在接受糖皮质激素治疗时可能会出现明显的高血糖,对此应予以警惕,并建议进行更频繁的血糖监测。在周期性使用糖皮质激素时,可能需要建议患者在疗程开始时显著增加胰岛素或口服降血糖药的剂量,并在停止糖皮质激素治疗时迅速减少剂量。这类患者往往需要更多的糖尿病专家来主动管理他们的高血糖。许多化疗方案提供日间病例或门诊护理管理。在这种情况下,糖尿病专家的支持和教育是必要的,如果患者的血糖水平出现严重问题,需要咨询内分泌专家。虽然目前循证医学证据依然不足,但普遍认为早晨给予基础中效胰岛素是有效的,因为该方式可以克服糖皮质激素引起的餐后高血糖,但如果高血糖仍然不受控制,就可能需要调整为预混胰岛素或基础+速效注射方案。
住院肿瘤患者经常会使用糖皮质激素,该药物可在有或无既往糖尿病的患者中诱发高血糖[94]。在确定胰岛素治疗方案时,必须考虑所用糖皮质激素的类型和作用时间。每天摄入的短效糖皮质激素,如泼尼松,在4~6 h内达到血浆峰值水平[95],其作用可持续1 d。早晨接受糖皮质激素治疗的患者白天血糖可能过高,但很多患者的血糖水平夜间可恢复正常[94]。在每天服用1~2次类固醇激素的受试者中,使用中效胰岛素是一种标准方法。中效胰岛素通常在每天基础胰岛素或口服降血糖药的基础上服用。因为中效胰岛素的作用在给药后4~6 h达到高峰,所以最好与类固醇激素同时给药[96]。对于长效糖皮质激素(如地塞米松)和多剂量或连续使用糖皮质激素,可能需要长效胰岛素来控制FPG[97-98]。对于更高剂量的糖皮质激素,除了基础胰岛素外,通常还需要增加餐前剂量,有时剂量会非常大[99-100]。无论何种情况,根据糖皮质激素剂量和床旁血糖检测结果的变化进行相应的调整都是至关重要的。若未合并其他器质性疾病,其控制目标通常为一般。
4.1.4.6 临终关怀
临终关怀的目的是使患者在适宜的环境中,以最少的医疗干预,实现无痛无症状的死亡。对于糖尿病患者,其中包括避免低血糖或高血糖。显然,在这种情况下,心血管并发症的长期预防变得不那么重要,应该与个人讨论如何减少用于预防血管并发症的药物(如血管紧张素转换酶抑制剂、他汀类药物、β受体阻滞剂和阿司匹林)[101]。也可以考虑停用抗高血糖药物,但应注意避免出现高血糖症状或高血糖失代偿。6~15 mmol/L的目标血糖范围可能是合理的,但如果患者无症状,也可以接受更高水平的血糖。随着疾病的进展和预后的恶化,建议进一步简化治疗方案,例如,每天1次长效胰岛素或口服治疗方案,特别是当饮食摄入不足时。如果饮食摄入不稳定,使用短效膳食葡萄糖调节剂可能有用。部分使用口服抗糖尿病药物或肠促胰岛素类似物治疗的肿瘤患者可能不需要更多的治疗或血糖检测就可以达标。胰岛素可以继续使用,理想情况下应每天给予1次长效胰岛素,仅在患者情绪激动时测试血糖水平,需要采取措施以避免低血糖,但如果患者缺乏决断能力,则应与其亲属讨论继续或停止喂养或输液。
推荐:
⑴ 当肿瘤糖尿病患者需要姑息治疗时,提供者应就治疗的目标和强度予以调整。严格控制血糖和血压可能不是必要的,应尽量减少治疗。同时,可以放松血脂管理的强度,必要时停止或降低降脂治疗的强度。A级
⑵ 总体舒适度、预防痛苦症状、维持生活质量和尊严是糖尿病肿瘤患者临终关怀管理的主要目标。C级
4.1.4.7 从住院到门诊的过渡
为患者个体化量身定制的结构化出院计划可减少住院时间和降低再入院率,并提高患者满意度。出院计划应在入院评估时开始,根据患者所患肿瘤的情况,评估患者糖尿病或高血糖及其并发症和共病情况,回顾既往血糖情况和危险因素控制情况,并协同患者及家属参与制定医疗计划,同时根据患者的病情和需求的变化随时更新。从住院过渡到门诊对所有患者都有风险。住院患者将出院到多种不同的环境,包括家庭(有或没有探视护士服务)、辅助生活、康复或对护理设施的熟悉程度。对于出院回家的患者来说,最佳方案将需要考虑糖尿病严重程度、患者疾病对血糖水平的影响以及患者的自理能力和偏好。对于所有在医院发生高血糖的患者,建议在出院后1个月内与社区医师、内分泌科医师或糖尿病专家进行门诊随访。如果出院时血糖药物改变或血糖控制不理想,最好提前预约(1~2周内),必要时可能需要多次会诊。根据入院时HbA1c水平调整的药物有助于指导治疗决策,并在出院后显著改善HbA1c水平[30]。因此,如果无法获得前3个月的HbA1c水平,建议检测所有住院的糖尿病或高血糖患者的HbA1c水平,并直接或通过出院总结与门诊医师进行沟通,有助于安全地过渡到门诊。提供有关高血糖原因、相关并发症和共病的信息,以及推荐的治疗方法,可以帮助门诊医师提高医疗质量。糖尿病合并肿瘤患者的再入院率为14%~20%,几乎是非糖尿病患者的2倍,导致再入院的因素包括男性、先前住院时间较长、先前住院次数较多、共病数量和严重程度、经济水平较低、教育程度较低。定期的家庭健康访视和及时的门诊随访可降低再入院率[102-103]。虽然目前没有有效确切的防止再入院的措施,但已经报告了一些成功策略,包括进行针对性的治疗,以及使用过渡性护理模式和以患者为中心的协作医疗中心,此外,年龄较大也是糖尿病患者再入院的重要危险因素[104]。
4.1.4.8 用药注意事项
⑴ 必须交叉检查患者所用的药物,以确保没有停止其他慢性病治疗药物,并确保新处方的安全性。
⑵ 应填写和审核新的或更换药物的处方,出院时或出院前与患者及家属联系。
⑶ 关于药物变化、待测试验及随访信息需求必须准确及时地传达给门诊医师。
⑷ 出院总结应在出院后尽快根据需要发送给初级保健提供者。
⑸ 出院前安排随访会增加患者就诊的可能性。
4.1.4.9 出院前处理
⑴ 确定出院后患者的随访方式。
⑵ 告知患者进行SMBG,并确定家庭血糖控制目标,进行电话随访。
⑶ 教育患者初步认识高血糖,以及如何处理和预防低血糖症。
⑷ 告知患者转诊医师的信息,并由营养师指导个体化饮食和用餐计划。
⑸ 告知患者如何正确服用降血糖药物,包括胰岛素注射。
⑹ 病假管理。
⑺ 正确使用和处置针头和注射器。
总之,应为患者提供长期和适当的医疗服务,包括设备、药物、用品(如血糖试纸)、处方及出院时的糖尿病教育。
推荐:
⑴ 应对患者进行完整的医学评估,包括:
① 确定糖尿病或高血糖的诊断和分类;② 评估糖尿病并发症和潜在的共病情况;③ 回顾患者既往的血糖情况和危险因素控制;④ 协同患者参与制定管理计划及后续更新。A级
⑵ 应以患者总体健康状况、并发症、心血管风险评估、低血糖症为基础,制定相应的肿瘤和血糖控制目标。B级
⑶ 应为患者制定个性化且结构化的出院计划。B级
5药物的影响
5.1 降血糖药对肿瘤的影响
5.1.1 胰岛素及胰岛素类似物
高胰岛素血症和高血糖是糖尿病和癌症之间联系的核心因素。IR是一种酪氨酸激酶,具有IR-A和IR-B两种异构体。IR-B主要在胰岛素敏感组织中表达,并通过激活PI3K途径发出代谢效应信号[1]。IR-A在胎儿组织和癌细胞中表达,并通过Ras/MAPK途径向细胞发出存活和增殖信号。这两种受体都通过激活IRS家族蛋白(包括IRS-1和IRS-2)发挥作用。IRS-1过表达也被证明具有致癌作用,通过促进细胞增殖,抑制基础和氧化应激诱导的自噬,最终减少NIH/3T3成纤维细胞的死亡[2]。有学者认为,长期使用人胰岛素和胰岛素类似物通过激活IR促进糖尿病相关癌症的发生[3]。细胞水平的研究[4]发现,短效胰岛素类似物具有类似于胰岛素的生物效应,然而,长效胰岛素类似物,如甘精胰岛素和地特胰岛素,已被发现与IR结合缓慢,但与IGF-1R结合更快,导致ERK途径激活,并增强胰岛素的促有丝分裂作用。长效类似物的使用可能与患癌症的风险增加有关[5]。甘精胰岛素是常用的长效胰岛素类似物,低血糖发生风险较低,然而,甘精胰岛素与癌症进展风险之间存在一定联系[4],使用甘精胰岛素的癌症发病率高于使用内源性胰岛素的癌症发病率,尤其是前列腺癌和乳腺癌[6-7],与没有使用胰岛素和没有慢性阻塞性肺疾病的患者相比,同时患有慢性阻塞性肺疾病的胰岛素使用者患肺癌的风险升高,有学者认为,胰岛素的使用与糖尿病患者患肺癌风险增加相关[5]。
然而,也有专家认为,与人胰岛素相比,在超过5年的随访中,并没有证据表明甘精胰岛素或地特胰岛素治疗后10种癌症的风险存在一致性差异,因此,在此领域尚有一定争议。迄今为止,还没有最终确定甘精胰岛素治疗会增加癌症进展的风险。新的长效德谷胰岛素对患癌风险的影响尚未可知[8]。
5.1.2 SU
SU是最广泛用于治疗糖尿病的一类抗糖尿病药物。SU是胰岛素的分泌促进剂,与癌症发生的高风险相关。接受SU单药治疗的2型糖尿病患者癌症发生率增加,与胰岛素治疗患者相似。然而,联合应用二甲双胍可提高SU治疗受试者的癌症发病率[9]。与单独使用二甲双胍治疗患者的死亡率相比,使用SU治疗患者的癌症相关死亡率增加,与胰岛素治疗患者的死亡率相同[10]。特殊类型的SU与不同的癌症发病率相关。与服用格列齐特的糖尿病受试者相比,服用格列本脲的糖尿病受试者的癌症死亡率和患癌风险显著升高[10-11]。以上所指的SU包含格列齐特、格列美脲、格列本脲和甲苯磺丁脲使用的患癌风险数据,尚无其他SU(氯丙咪嗪和格列吡嗪)的数据[12]。
5.1.3 二甲双胍
目前很多专家认为二甲双胍可以降低患癌风险。接受二甲双胍治疗可降低23%的患癌风险,癌症进展的发生率较低[13]。与胰岛素或SU治疗的患者相比,服用二甲双胍的患者降低了癌症相关死亡率。二甲双胍治疗已被证明与延长寿命和降低癌症发病率有关[14]。二甲双胍也显著有益于癌症预后,其主要机制是降低导致腺苷-磷酸(adenosine monophosphate,AMP)与ATP比率增加的ATP水平,从而激活肝激酶-B1(liver kinase-B1,LKB1)-AMP活化蛋白激酶(AMP activated protein kinase,AMPK)信号转导通路[15];同时二甲双胍也可以LKB1-和AMPK-非依赖性方式抑制肝脏葡萄糖生成[16]。因此,二甲双胍是通过靶向多种途径抑制癌细胞生长,其抗癌特性已经在多项实验中得到了一定程度的印证[15-18]。因此,二甲双胍可作为预防糖尿病人群患癌的安全药物。但二甲双胍对癌细胞的直接抑制作用还缺乏大规模临床研究数据的支持[19]。因此,需要长期、随机的前瞻性研究来证实二甲双胍的潜在益处。
但有专家经过分析后认为,很多观察性研究存在时间偏差,且没有回顾分析时间窗偏差,并且在比较二甲双胍一线治疗与二、三线治疗时没有考虑固有的时间滞后问题,导致了不真实的、夸大的结果[20-21]。还有学者认为,二甲双胍与癌症之间可能不存在关联,在开始二甲双胍治疗癌症的随机对照试验之前,需要进行仔细的重新评估[22-23]。因此,二甲双胍的抗癌作用尚需更多大规模多中心的临床试验证实。
5.1.4 噻唑烷二酮类(thiazolidinedione,TZD)药物
TZD是另一类用于治疗2型糖尿病的药物,TZD作为核受体过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ,PPAR-γ)的激动剂可增强胰岛素敏感性。PPAR-γ在脂肪肉瘤、肺癌和前列腺癌中介导细胞周期阻滞并具有肿瘤抑制活性,在大肠腺瘤性息肉病APCmin/+小鼠中抑制结肠息肉形成,同时,TZD在体内和体外的使用也可抑制部分癌细胞的生长[24-25]。部分专家认为,吡格列酮治疗有一定的致膀胱癌风险[26],但也有学者认为,使用TZD治疗与糖尿病患者的肺癌、肝癌和结直肠癌发病率降低有关[27-28]。罗格列酮在糖尿病患者中的使用与很多恶性肿瘤发病率无关,但目前观察的时间很多不到1年[29]。因此,评估TZD的安全性可能需要更长的观察时间。
5.1.5 肠促胰岛素药物和DPP-4抑制剂
肠促胰岛素属于胃肠激素,可促进β细胞分泌胰岛素。由于胰腺癌可见于接受GLP-1治疗的患者,因此引起了研究者对肠促胰岛素在胰腺癌发展中长期作用的警惕,GLP-1治疗对恶性肿瘤发生的影响仍存在争议,可能与瘤种有关,例如,有研究发现,更高的GLP-1受体表达与子宫内膜癌更好的预后相关[29-30]。葡萄糖依赖性促胰岛素多肽(glucose-dependent insulinotropic polypeptide,GIP)和GLP-1属于肠促胰岛素家族,GIP通过7次跨膜G蛋白偶联受体发挥作用,GIP受体(GIP receptor,GIPR)广泛分布于胰腺、胃肠道、血管内皮、脂肪组织和大脑等器官或组织中[31]。GIPR可激活腺苷酸环化酶活性,增加环腺苷-磷酸(cyclic adenosine monophosphate,cAMP),GIP-GIPR轴具有增殖和抗凋亡作用,通过激活MAPK信号,进一步激活PI3K/Akt信号转导通路[32]。GIPR在脂肪组织中的低表达与胰岛素抵抗和肥胖有关。除了与代谢性疾病相关外,GIP-GIPR轴也因其在某些人类内分泌肿瘤中的不适当表达和激活而受到关注,因为GIP-GIPR轴可能参与肿瘤的发展[33]。同时,GIPR在胃肠道和支气管肿瘤中广泛表达,在神经内分泌肿瘤中的表达更高[34],且在癌细胞中的表达增强,而在周围健康组织中表达减弱,提示GIPR可作为神经内分泌肿瘤显像和放疗的分子靶点[35]。
GIPR在肾上腺肿瘤、垂体肿瘤及神经内分泌肿瘤中的表达各不相同,但无论肿瘤的类型和来源如何,cAMP信号在所有GIPR阳性肿瘤中均被激活,而在GIPR阴性肿瘤中则不被激活。因此,在确定用于治疗2型糖尿病患者的肠促胰岛素类似物时,最好能避免GIPR阳性内分泌肿瘤的存在。
GLP-1在体内被DPP-4降解,DPP-4是一种细胞表面糖蛋白,也称为CD26。GLP-1对肿瘤生物学行为有多方面影响,具体取决于肿瘤类型和肿瘤微环境。DPP-4抑制剂是治疗2型糖尿病和糖尿病并发症的重要药物。DPP-4的致瘤作用在不同的肿瘤中不同[36]。如在星形细胞瘤、胃肠道间质瘤和某些淋巴瘤中,DPP-4的高表达与肿瘤的侵袭性有关[37]。相反,在某些恶性肿瘤的晚期(包括黑色素瘤、子宫内膜癌和肺鳞状细胞癌)中,DPP-4表达会缺失[38]。在尿路上皮癌中,DPP-4的过度表达与肿瘤细胞生长、增殖以及增强的细胞迁移和侵袭相关,抑制DPP-4可减弱尿路上皮癌细胞的侵袭性并促进其凋亡[39]。
DPP-4抑制导致内源性GLP-1和GLP-2水平升高。DPP-4在癌症进展和转移中发挥重要作用[40]。然而,长期使用DPP-4抑制剂治疗2型糖尿病一直存在争议,虽然美国FDA认为,与使用安慰剂或其他药物治疗的患者相比,使用DPP-4抑制剂治疗的2型糖尿病患者患癌风险并不高[41],但也有研究者认为,使用西格列汀治疗致胰腺癌的发生率是其他治疗方法的2.7倍[42]。最近,使用沙格列汀对糖尿病心肌梗死溶栓患者血管结局的评估(SAVOR-TIMI 53)和使用西格列汀评估心血管结局的试验也证明,胰腺癌的患病风险没有显著增加,且沙格列汀对结肠癌有保护作用[43-44]。很多基础和临床转化研究也得出不一样的结果,如抑制DPP-4不会增加肿瘤发生率,但可能促进多个肿瘤细胞系发生转移[44]。在多种恶性肿瘤细胞中发现DPP-4水平升高,且化疗敏感性增加[46-47]。由此看来,DPP-4与肿瘤之间的关系复杂,还需要进一步研究。
5.1.6 SGLT2抑制剂在癌症中的应用
SGLT2是参与肾小管葡萄糖重吸收的主要共转运蛋白,SGLT2抑制剂通过选择性抑制肾脏葡萄糖重吸收和增加尿糖排泄来降低血糖水平[48]。此外,SGLT2抑制剂还使患者有其他获益,如减轻体重和降低血压[49]。在临床实践中,如果患者不能通过一种或多种其他抗糖尿病药物达到血糖控制,SGLT2抑制剂可与二甲双胍和(或)其他药物联合使用,作为二线治疗(联合治疗)。
目前大部分学者未发现使用SGLT2抑制剂的糖尿病人群的患癌风险增加,然而,考虑到目前研究观察时间较短,未来需要长期前瞻性研究和上市后监测研究加以证实[50]。
虽然在使用特异性SGLT-2抑制剂治疗的患者中观察到膀胱癌和乳腺癌的患病风险增加,推测可能是随机化前缺乏详细诊断,而非因果关系[51]。人类中其他SGLT2抑制剂致膀胱癌或乳腺癌的患病风险升高尚未见报道,SGLT2抑制剂可能在啮齿动物中诱发肿瘤[52-53]。但动物实验不足以证明使用SGLT2抑制剂在人类中具有致癌风险。而且,SGLT2抑制剂在体内外的肾细胞癌变过程中显示出抗癌作用并抑制肿瘤生长[54]。也有研究者认为,使用SGLT2与未使用SGLT2的人群相比并未增加恶性肿瘤的发生率[55-56]。然而,这些并不能完全排除患癌风险增加的可能性,还有专家认为,SGLT2抑制剂可增加部分恶性肿瘤如膀胱癌和乳腺癌的患病风险,但尚未排除糖尿病、肥胖及感染等干扰因素所致的偏倚[57-58],这些需要在大型临床试验及长期观察研究中进一步分析。
总之,现有的随机对照试验并未证明SGLT2抑制剂与总体患癌风险增加之间存在显著联系。有研究[50]表明,SGLT2抑制剂(empagliflozin)可能增加患膀胱癌的风险,而卡格列净可能有抵抗胃肠道癌的作用。然而,考虑到纳入分析的随机对照试验的短期设计,SGLT2抑制剂对癌症的长期影响仍不确定。常见糖尿病药物和肿瘤风险见表3。
5.2 恶性肿瘤治疗药物与血糖
癌症治疗除手术治疗外,还包括放疗、化疗及免疫治疗等改变细胞信号转导通路并影响肿瘤代谢的治疗。其中一些疗法可能导致暂时性或永久性糖尿病。靶向肿瘤生长的两种主要疗法[mTOR抑制剂(依维莫司和替西罗莫司)和酪氨酸激酶抑制剂(尼罗替尼和帕唑帕尼)]与高血糖有关。依维莫司导致12%的肾细胞癌、5%的胰腺癌或胃肠道癌以及4%的乳腺癌患者出现高血糖[59]。尼罗替尼导致5%的慢性粒细胞白血病患者出现高血糖[60]。靶向PI3K/Akt信号转导通路的抑制剂也可诱导高血糖。高达8.4%的接受PI3K抑制剂(BKM120)治疗的受试者出现高血糖。直接靶向IR或IGF-1R可导致更高比例的患者出现高血糖。接受PI3K/Akt/mTOR途径抑制剂治疗的患者会出现3和4级高血糖(对照组为6.7%和0.0%)[61]。大剂量糖皮质激素通常被用作癌症治疗的佐剂,但会导致高血糖和胰岛素抵抗[62]。雄激素剥夺疗法被用来治疗前列腺癌。此外,睾酮抑制与胰岛素抵抗有关[63]。只有12.5%的雄激素剥夺治疗患者出现胰岛素抵抗[64]。由于糖尿病男性患者前列腺癌的发病率较低,在雄激素剥夺治疗期间表现出高血糖可能更为显著。嘧啶类似物(5-氟尿嘧啶)抑制RNA合成并引起DNA损伤,被用于治疗胰腺癌[65]。5-氟尿嘧啶诱导的高血糖发生在26.1%的结直肠癌患者中,13.2%的患者发展为糖尿病[61]。顺铂可促进癌细胞凋亡,用于治疗多种癌症。在头颈部癌症患者中,5%的患者使用顺铂导致一过性糖尿病[66]。抗肿瘤药物导致高血糖的机制见表4。有研究[67]发现,放疗与糖尿病相关,但其分子机制仍不清楚。

6肿瘤相关性高血糖和糖尿病的长期随访管理
与普通人群相比,糖尿病患者患多种常见癌症的风险增加。因此,应鼓励糖尿病患者早期接受癌症筛查和随访管理,并减少其可改变的患癌风险因素(肥胖、缺乏体育锻炼和吸烟),尤其是那些新发非典型糖尿病患者应进行胰腺癌的筛查和随访[1-2]。即使在发达国家,糖尿病患者的癌症筛查率也明显低于非糖尿病患者,尤其是老年人群[1-3]。同时,对于合并高血糖和糖尿病的肿瘤患者,由于已明确高血糖和糖尿病会影响肿瘤患者预后[3-4],因此,公共卫生工作应强调长期预防的重要性,包括对未合并肿瘤的糖尿病高危人群和已合并高血糖和糖尿病的肿瘤患者进行长期筛查和随访管理。
6.1 档案的建立
初诊肿瘤相关性高血糖患者由医疗机构在建立居民健康档案的基础上,建立糖尿病患者管理档案,要详细询问所患肿瘤类型、治疗情况及糖尿病病情,是否存在其他合并症等。肿瘤相关性糖尿病患者的健康档案至少应包括患者健康体检、年度评估和随访记录。随着信息化系统的不断完善,医疗卫生服务信息的互联互通,患者的就诊记录、转会诊及住院记录均应纳入健康档案之中。肿瘤诊治机构应该为肿瘤相关性糖尿病患者建立个人档案,统一保存在电子数据中心,注意隐私保护。纸质档案由责任医务人员或档案管理人员统一汇总、及时归档。
6.2 健康检查与评估
糖尿病作为慢性疾病,应对患者定期随访进行健康检查和病情评估,肿瘤相关性高血糖患者,考虑其病情的特殊性,必须做好高血糖的筛查和监测,针对不同肿瘤分期的患者有不同的检查及评估要求。提倡设计专门化的纸质或电子表格,记录SMBG或CGM的数据、体重、饮食、运动、用药等情况,以利于高效随访。基于互联网的远程管理对肿瘤相关性高血糖的控制可能增强患者的依从性,提高诊疗效率[5],但尚缺乏来源于肿瘤患者的循证医学证据。肿瘤相关性高血糖的管理具有跨学科的特点,此类患者血糖控制目标、治疗路径、用药禁忌与普通糖尿病患者有较大差异,有条件的内分泌代谢专科可建立肿瘤相关内分泌代谢异常亚专业。
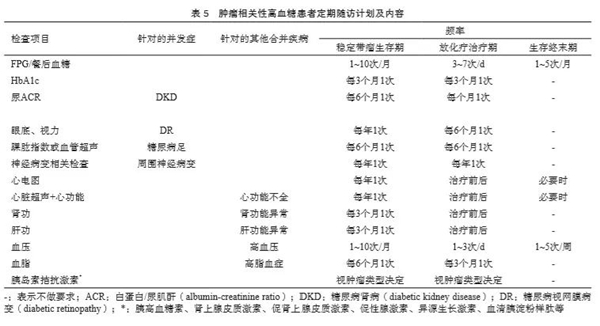
随访的内容根据患者具体情况而定,包括:患者营养状况和体重变化,是否发生脱水、纳差、感染等可能诱发急性并发症的情况;SMBG结果的评价[6],评估血糖控制是否达标;查看患者近期变更的抗肿瘤治疗方案中可能引起高血糖的药物[7],是否需要相应地调整降血糖方案;是否发生低血糖,确定低血糖发生的原因并采取处理措施;评估降血糖治疗方案的有效性和患者的依从性,监测降血糖药的不良反应情况;根据患者肿瘤病情和抗肿瘤治疗方案变化调整控糖目标;提供饮食、运动、生活方式、并发症预防的健康指导。每次随访应评估是否存在酸碱电解质紊乱[8],检测肝功能、肾功能、电解质、静脉FPG等项目,每2~3个月检测HbA1c,每年检测尿微量白蛋白或白蛋白/肌酐比值,每年进行眼底筛查。
既往无糖尿病病史者,应于基线及每次就诊时检查血糖(推荐行HbA1c检测)、询问患者低血糖/高血糖征兆及症状;具体目标参见本指南“肿瘤相关性高血糖的控制目标”一节。对于已发生高血糖的肿瘤患者,定期随访计划及内容见表5。
6.3 随访与管理建议
针对肿瘤相关性高血糖患者,建议每6个月面对面或电话随访了解个体健康情况,包括有无并发症或合并症、血糖控制情况、健康状况改善与否、肿瘤控制情况和治疗情况等。
糖尿病前期与肿瘤风险增加相关,对于糖尿病高危的肿瘤患者,应尽早识别糖尿病高危因素和糖尿病前期状态,及时发现需要干预的高血糖。根据血糖升高的不同机制,通过生活方式干预和(或)药物干预分别进行对应处理,预防或延缓该人群发展成为糖尿病或预防糖尿病慢性并发症,提高患者生存率和生活质量。
糖尿病相关并发症如肾病、血管病变和神经病变等都可能会影响化疗药物的剂量,增加不良反应的发生风险,影响化疗效果,导致复发率和死亡率升高。因此,对于已发生糖尿病的肿瘤患者需要积极干预,主要目的在于减少长期带瘤生存患者的糖尿病并发症发生风险。基层可进行随访服务记录及糖尿病人群的干预管理。部分抗肿瘤药物对血糖有明显影响,因此除上述检查与评估外,肿瘤患者在糖尿病治疗过程中,应与内分泌科医师保持密切联系,针对不同肿瘤的化疗药物或治疗阶段,合理选择抗糖尿病药物。
肿瘤患者在进行肿瘤专科定期随访时,应同期至内分泌代谢专科就血糖控制及其他代谢异常情况进行定期随访,防治高血糖及其相关并发症。肿瘤相关性高血糖定期随访的频率应体现个体化原则,可依据病情严重程度和治疗时期而定,初期一般每个月1次,病情稳定后可2~3个月1次。肿瘤患者围手术期,在进行化疗、放疗、生物治疗、内分泌治疗、分子靶向治疗和中医治疗的过程中,应对血糖进行检测,发现非预期的、难以纠正的或明显的血糖异常时应至内分泌代谢专科随访。为确保肿瘤患者的安全和有效治疗,发挥分级诊疗的优势和协同作用,患者的治疗应当实施双向转诊。二、三级临床医疗机构负责患者的临床治疗方案的确定和调整;社区卫生服务中心(乡镇卫生院)负责患者的维持治疗和常规复查。社区卫生服务中心(乡镇卫生院)应主动与上级医院协调建立患者转诊制度,及时将病情恶化的患者转诊至上级医疗机构,待患者治疗方案确定且病情稳定后再转回社区卫生服务中心进行管理。
推荐:
⑴ 应鼓励使用SMBG进行胰岛素治疗的患者按其胰岛素治疗方案检测血糖是否正常。包括禁食时、饭前和零食前、睡前、运动前、怀疑低血糖时、治疗低血糖直至血糖正常后、执行诸如驾驶等关键任务之前和这期间的血糖检测。B级
⑵ 血糖仪应使用经测试准确的仪器和试纸条,建议从正规药房或授权经销商处购买。E级
⑶ SMBG可帮助作出治疗决策,尤其适用于使用胰岛素的患者。B级
⑷ 尽管接受非胰岛素治疗的患者中良好的SMBG并不一定会带来临床上HbA1c的显著降低,但当结合治疗调整计划改变饮食、体力活动和(或)药物(尤其是使用可能导致低血糖的药物)时,SMBG可能会有所帮助。E级
⑸ 患者应接受持续和定期的指导,以保证他们有操作仪器和分析数据的基本能力,包括上传和共享SMBG设备的数据(如适用)以调整治疗。E级
7肿瘤患者高血糖的分级诊疗
7.1 上转至二级及以上医院的标准
7.1.1 初次发现血糖异常,病因和分型不明确者
肿瘤患者血糖水平不能区分1型还是2型糖尿病。在患者起病初期进行分类有时很困难。而对于特殊类型糖尿病,除典型临床表现及家族史外,可能仍需要基因检测才能明确病因[1-2]。急性感染、创伤或其他应激情况下可出现暂时性血糖升高,若无明确糖尿病病史,不可根据此时的血糖水平诊断糖尿病,需在应激因素消除后复查,再确定糖代谢状态[3]。
7.1.2 儿童和青少年糖尿病患者
儿童和青少年(年龄<18岁)肿瘤合并糖尿病患者,尤其怀疑特殊类型糖尿病时,可上转至二级及以上医院以明确诊断[1]。特殊类型糖尿病临床表现可能同时具有1、2型糖尿病的特征,因其准确诊断后治疗方案及预后截然不同[4],故当基层医院医师不能对其进行准确诊断及分型时,应及时向上转诊,从而减少误诊、漏诊,制定合理治疗方案。
7.1.3 妊娠和哺乳期妇女血糖异常者
肿瘤患者的妊娠期血糖管理同普通患者,妊娠期间高血糖的主要危害是围生期母婴临床结局不良和死亡率升高,包括胎儿在宫内发育异常、新生儿畸形、巨大儿和新生儿低血糖发生风险增加等[5]。与妊娠相关的糖尿病包括妊娠糖尿病、妊娠期显性糖尿病、孕前糖尿病和哺乳期妇女血糖异常[3,6]。
⑴ 妊娠糖尿病( gestational diabetes mellitus,GDM):是指妊娠期间发生的糖代谢异常,但血糖未达到显性糖尿病的水平。孕期任何时间行75 g OGTT,5.1 mmol/L≤FPG<7.0 mmol/L,OGTT 1 h血糖≥10.0 mmol/L,8.5 mmol/L≤OGTT 2 h血糖<11.1 mmol/L,上述血糖值之一达标即诊断。
⑵ 妊娠期显性糖尿病( overt diabetes mellitus,ODM):孕期任何时间被发现且达到非孕人群糖尿病诊断标准。
⑶ 孕前糖尿病(pre-gestational diabetes mellitus,PGDM):怀孕前确诊的1、2型或特殊类型糖尿病。
⑷ 哺乳期妇女血糖异常:应鼓励和支持包括患者在内的所有妇女进行母乳喂养。母乳喂养可为婴儿提供及时的营养和免疫获益。
肿瘤患者安全性是转诊至关重要的核心原则。妊娠和哺乳期妇女血糖异常转诊可选择择期转诊,待血糖控制稳定后以就诊便利性为原则转诊至专科医院或综合性医院。其血糖控制标准为:患者无明显饥饿感,FPG控制在3.3~5.6 mmol/L,餐前30 min血糖控制在3.3~5.8 mmol/L,餐后2 h血糖控制在4.4~6.7 mmol/L, 而夜间血糖则控制在4.4~6.7 mmol/L,控制血糖的方式主要有饮食调节、合理运动、口服药物和胰岛素治疗等[7]。
7.1.4 糖尿病急性并发症
7.1.4.1 DKA
由于胰岛素严重缺乏和升糖激素不适当升高引起的糖、脂肪和蛋白代谢严重紊乱综合征,临床以高血糖、高血清酮体和代谢性酸中毒为主要表现。DKA发生的常见诱因包括急性感染、胰岛素不适当减量或突然中断治疗、饮食不当、胃肠疾病、脑卒中、心肌梗死、创伤、手术、妊娠、分娩、精神刺激等[8]。
临床表现:意识障碍、深大呼吸、呼出气有烂苹果味等。
转诊前处理:急测血糖水平通常在16.7~33.3 mmol/L或超出血糖仪检测范围,急测血酮(或查尿酮体,无条件时);生理盐水快速静脉滴注并维持小剂量胰岛素(4~6 U/h);保持呼吸道通畅;急救车就近转诊至综合性医院。
7.1.4.2 高渗高血糖综合征(hyperglycemic hyperosmolar syndrome,HHS)
HHS是糖尿病的严重急性并发症之一,临床以严重高血糖而无明显酮症酸中毒、血浆渗透压显著升高、脱水和意识障碍为特征。
临床表现:意识障碍、脱水、低血压等。
转诊前处理:急测血糖水平通常达到或超过33.3 mmol/L,亦或超出血糖仪检测范围;急测血酮(或查尿酮体,无条件时);生理盐水快速静脉滴注并维持小剂量胰岛素(4~6 U/h);保持呼吸道通畅;急救车就近转诊至综合性医院[9]。
7.1.4.3 乳酸性酸中毒
乳酸性酸中毒是高阴离子间隙性酸中毒,由大量乳酸在体内堆积所致。因各种原因致组织缺氧,乳酸生成过多,或因肝脏疾病使乳酸利用减少和清除障碍,则血液中乳酸浓度升高。
临床表现:乳酸性酸中毒起病较急,有深大呼吸(不伴酮臭味)、神志模糊、嗜睡、木僵、昏迷等症状,可伴恶心、呕吐、腹痛。缺氧引起者有发绀、休克及原发病表现。药物引起者常有服药史及相应中毒表现。但本病症状与体征可无特异性,轻症临床表现可不明显,可能仅表现为呼吸稍深快,常被原发或诱发疾病的症状所掩盖,应注意避免误诊或漏诊。
转诊前处理:立即予以吸氧等一般措施,并做好人工呼吸的各种准备。治疗过程中,应密切注意血压、脉搏、呼吸等生命体征的变化,加强病情观察,及时进行血乳酸、血气分析(pH、HCO3-)、血糖、血电解质、阴离子间隙等血生化检查,并密切随访复查;纠正休克是治疗乳酸性酸中毒的重要措施,补液扩容可改善组织灌注,减少乳酸产生,利尿促进排酸。输液宜用生理盐水,避免使用含乳酸的溶液。肾上腺素和去甲肾上素会强烈收缩血管,减少肌肉、肝脏血流量,应禁用;纠正酸中毒等,保持呼吸道通畅;急救车就近转诊至综合性医院[9-10]。
7.1.5 反复发生低血糖
如患者出现交感神经兴奋(如心悸、焦虑、出汗等)或中枢神经症状(如神志改变、认知障碍、抽搐和昏迷等)时应考虑低血糖的可能,及时监测血糖。肿瘤合并糖尿病患者只要血糖水平≤3.9 mmol/L就属低血糖范畴。
转诊前处理:急测血糖帮助诊断;症状较轻者给予葡萄糖、含糖饮料或食物即可缓解;若反复出现症状者,应在监护下转诊至综合医院;症状较重者应静脉推注50%的葡萄糖溶液40 mL,症状缓解后,应在监护下由急救车转诊至综合医院[1]。
7.1.6 血糖、血压、血脂治疗3个月不达标者
长期血糖、血压、血脂控制不达标可使心血管病、脑卒中、肾病及视网膜病变的发生和进展风险明显增加,也会增加肿瘤患者的死亡率。临床证据显示,对多重危险因素的综合控制可显著改善患者心脑血管病变和死亡发生的风险[2]。因此,对于在基层医疗卫生机构治疗3个月以上血糖、血压、血脂未达标的患者,应上转至二级及以上医院,调整治疗方案,使血糖、血压和血脂控制达标。具体标准:
① 血糖达标:FPG<7.0 mmol/L,餐后2 h血糖<10.0 mmol/L,HbA1c<7.0%;② 血压达标:收缩压/舒张压<140/80 mmHg;③ 血脂达标:低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)<2.6 mmol/L,或他汀类药物已达最大剂量或最大耐受剂量。符合以上标准可考虑下转至基层医疗卫生机构继续治疗[11]。
7.1.7 糖尿病慢性并发症
肿瘤患者出现糖尿病慢性并发症,包括视网膜病变、肾病、神经病变、糖尿病足(diabetic foot,DF)或周围血管病变,基层医师作为基本医疗资源的实践者,应该认识到基层治疗的局限性,合理地向其他医疗机构转诊患者,确保全民享有优质医疗服务,转诊过程中将患者安全作为至关重要的核心原则。
转诊前处理:择期转诊者,转诊前应备齐病历资料;急症转诊者,应给予紧急对症处理维持生命体征,尽可能保证转诊过程的安全性[12]。
具体转诊流程如下[13-14]:
⑴ 微血管并发症(包括DR及DKD)以下情况建议转往上级医院:① 基层医疗卫生机构缺乏糖尿病微血管并发症筛查设备;② 糖尿病微血管并发症患者需调整治疗方案;③ 糖尿病患者出现严重微血管并发症或病情进一步恶化,基层医疗卫生机构缺乏进一步改善微血管并发症的治疗手段,医患双方均同意转往上级医院就诊。
DR筛查与防治双向转诊流程见图1。建议将免散瞳眼底照相机作为基层医疗卫生机构筛查DR的首选设备进行配置,在无相关技术及设备的情况下,建议转诊至上一级医院进行检查。DR分期标准如下:① 轻度非增殖性糖尿病视网膜病变(non-proliferative diabetic retinopathy,NPDR),微小动脉瘤,通常发生于疾病早期, 可导致液体渗透;② 中度NPDR,供氧视网膜血管可发生水肿和变形,并且失去供血能力,导致特征性视网膜血管病变,并加重或促进黄斑水肿形成;③ 重度NPDR,血管阻塞范围扩大,导致视网膜无灌注区扩大,这些区域可释放促进视网膜新生血管生成生长因子,导致视网膜新生血管生成;④ 增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR),新生血管在视网膜内表面和玻璃体内增殖,沿视网膜内表面生长并进入玻璃体,眼内渗出增多,新生血管相对脆弱,更易发生渗出和出血。
DKD筛查与防治双向转诊流程见图2。建议将尿ACR作为基层医疗卫生机构DKD筛查的首选方法。根据肾脏损伤和估算肾小球滤过率(estimated glomerular filtration rate,eGFR)评估慢性肾脏病(chronic kidney disease,CKD)严重程度,对CKD 的肾功能进行分期:G1期为肾脏损伤伴eGFR正常或增加[eGFR≥90 mL/(min×1.73 m2)];G2期为肾脏损伤伴eGFR轻度下降[eGFR:60~89 mL/(min×1.73 m2)];G3a期为eGFR轻中度下降[eGFR:45~59 mL/(min×1.73 m2)];G3b 期为eGFR中重度下降[eGFR:30~45 mL/(min×1.73 m2)];G4期为eGFR重度下降[eGFR:15~29 mL/(min×1.73 m2)];G5期为肾衰竭[eGFR<15 mL/(min×1.73 m2)或透析]。
⑵ 糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)筛查与防治双向转诊流程见图3。
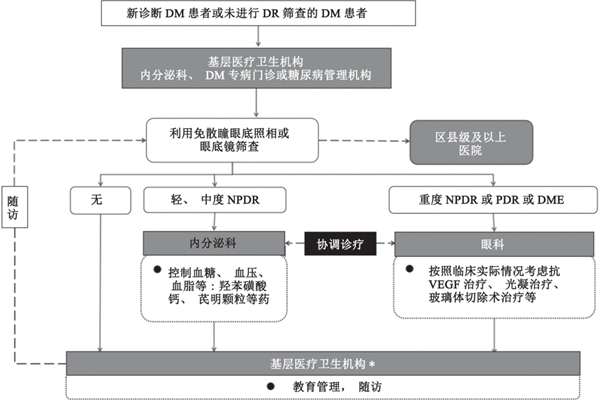
图 1 DR筛查与防治双向转诊流程图
DM:糖尿病;DR:糖尿病视网膜病变;NPDR:非增殖性糖尿病视网膜病变;PDR:增殖性糖尿病视网膜病变;DME:糖尿病黄斑水肿;VEGF:血管内皮生长因子。*:基层医疗卫生机构包括乡镇卫生院、村卫生室及城市社区卫生服务中心(站)
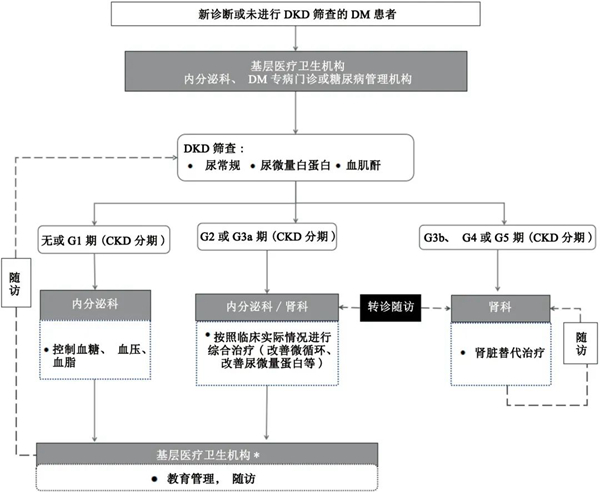
图 2 DKD筛查与防治双向转诊流程图
DKD:糖尿病肾病;DM:糖尿病;CKD:慢性肾脏病。*:基层医疗卫生机构包括乡镇卫生院、村卫生室及城市社区卫生服务中心(站)
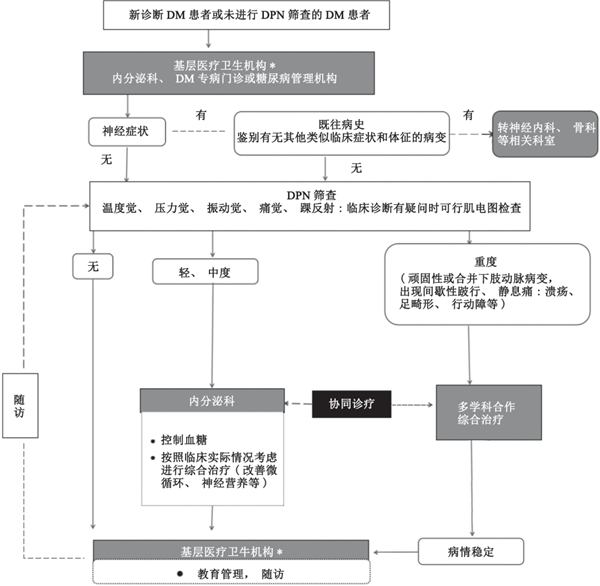
图 3 DPN筛查与防治双向转诊流程图
DM:糖尿病;DPN:糖尿病周围神经病变;*:基层医疗卫生机构包括乡镇卫生院、村卫生室及城市社区卫生服务中心(站)
⑶ DF或周围血管病变以下情况需要转往上级医院:① 基层医疗机构缺乏DF相关筛查设备;② DF患者基础情况较差,合并症或并发症较多,需要调整综合治疗方案;③ 病情较重或病情进展较快,基层医疗机构缺乏进一步治疗手段;④ 医患双方均同意转往上级医院。
具体转诊如下:
① 糖尿病周围血管病变的治疗:糖尿病周围血管病变导致肢体严重缺血,Fontaine分期Ⅲ、Ⅳ期,或Rutherford分级4级及以上,临床表现为患肢静息痛或溃疡坏疽;严重的患肢间歇性跛行,影响生活质量,Fontaine分期Ⅱb期,或Rutherford分级3级;踝肱指数<0.6的患者。出现上述几种情况,建议转诊DF中心或相关专科会诊行手术治疗来挽救肢体或降低截肢平面。
② DF创面治疗:一旦出现皮肤颜色的急剧变化、局部疼痛加剧并有红肿等炎症表现、新发溃疡、原有的浅表溃疡恶化并累及软组织和(或)骨组织、播散性的蜂窝组织炎、全身感染征象、骨髓炎等,应该及时转诊至上级医院。
③ DF抗感染治疗:深部脓肿、腔室筋膜综合征、坏死性软组织感染、部分中度和所有重度。
④ DF感染者需紧急转至区域性DF诊疗中心。
⑤ DF压力异常治疗:足部畸形及足底有胼胝者转往上级医院行足底压力及步态分析,并予以特殊装置,如定制鞋垫进行加压及调整压力分布;如已出现压力性溃疡,除非特定的处方鞋,不建议继续使用原来的鞋具,同时建议转往有条件的医院行支具治疗;溃疡已愈合者,应制定合理的保护计划,使患者从全接触的支具治疗过渡到新的治疗鞋阶段,以防止溃疡复发。
⑥ DF全身支持治疗:中重度贫血、低蛋白血症、糖脂代谢控制较差、水电解质酸碱平衡紊乱、下肢血供中重度异常、保护性感觉缺失、中重度感染、心脑肺肾等多脏器功能不全等应及时转诊到区域性DF诊疗中心。
⑦ DF的矫形:建议有条件的二级及以上医院或DF诊治中心进行DF的矫形。
⑧ 心理治疗:Wagner分级4、5级阶段,建议转上级医院并请心理医师干预。
7.1.8 糖尿病慢性并发症导致严重靶器官损害需要紧急救治的肿瘤患者
肿瘤患者的安全是至关重要的。社区医师必须认识到自身能力和采取相应措施的局限性,最大限度发挥社区医师和专科医师各自优势及二者间协同作用,最高品质地确保患者全程安全。对出现糖尿病慢性并发症导致严重靶器官损害需要紧急救治的肿瘤患者,应在进行必要的紧急处理的同时,及时上转至二级及以上医院实施救治,具体包括以下几个方面。
7.1.8.1 急性心脑血管疾病
急性心脑血管疾病具有发病急促、致死致残率高的特点,尽快进行早期干预是改善患者预后的可靠措施,然而基层医疗卫生机构可能难以满足急性心脑血管疾病的救治需求。基层医疗卫生机构应迅速评估患者意识、大脑反应、瞳孔、生命体征、发病时间,同时给患者供氧、建立静脉通道等,并迅速联系上级医疗机构,及时转诊[15]。
7.1.8.2 DKD导致的肾功能不全[eGFR<60 mL/(min×1.73 m2)]或大量蛋白尿
当DKD患者出现肾功能不全[eGFR<60 mL/(min×1.73 m2)]或大量蛋白尿时,即提示患者肾功能不全已经达到至少G3a期,此时若不能及时予以改善微循环、改善尿蛋白治疗,肾功能不全极有可能继续恶化,发展至G3b、G4甚至G5期即肾衰竭期,此时患者往往需要肾脏替代治疗及系统检查,基层医疗卫生机构条件有限,应积极转诊至上级医院治疗[13]。
7.1.8.3 DR导致的严重视力下降
DR是常见的致盲性眼病。对于突发明显视力下降、眼红痛、眼前黑影飘动而原因不明的患者,提示可能出现眼底严重损害,需转至眼底病诊疗能力较强的综合医院或眼科专科医院,确定治疗方案,尽快采取有效的干预措施,以降低致盲率[16]。
7.1.8.4 糖尿病外周血管病变导致的间歇性跛行和缺血性症状
糖尿病合并下肢动脉病变是导致足部溃疡和下肢截肢,特别是高位截肢和再次截肢的主要原因。当患者出现间歇性跛行及静息痛、周围动脉搏动减弱或消失、缺血性溃疡等缺血性症状时,往往提示血管病变已发展至晚期,此时主要依赖外科治疗,包括下肢血管重建和截肢。基层医疗卫生机构通常不具备实施外科治疗的条件,应及时转至上级医院治疗[17]。
7.1.8.5 DF
DF患者通常为高龄、病程长、感染重、下肢血管及神经病变较重的患者,病情复杂,治疗涉及多个学科,基层医师对DF的诊疗认识存在不足,基层卫生医疗机构治疗手段有限,对于病情危重的患者容易延误病情,导致截肢风险增加。对于以下DF患者,应转至上级医疗机构治疗:① 基层医疗机构缺乏相关筛查设备;② 患者基础情况差,合并症或并发症较多,需要调整综合治疗方案;③ 病情较重或病情进展较快,基层医疗机构缺乏进一步治疗措施;④ 医患双方均同意转往上级医院就诊[14]。
7.1.9 血糖波动较大、基层医疗机构处理困难或需要制定胰岛素控制方案的肿瘤患者
基层医师通常情况下仅可减量或停用胰岛素,除非经专门培训与授权;胰岛素强化治疗方案或启用胰岛素泵治疗,应由专科医师制定;糖尿病急症的胰岛素紧急处置不受基层医师等级限制[1]。因此,对于血糖波动较大,基层处理困难或需要制定胰岛素控制方案者应转至上级医疗卫生机构进行血糖管控。研究[18]表明,对于血糖波动较大、基层医师处理困难的肿瘤病患者,由专科医师为患者制定个体化降血糖方案,全科医师进行跟踪随访管理干预6个月后,干预组患者的糖化血红蛋白和血糖均较对照组降低,说明通过6个月的药物调整和多学科联合管理,患者的血糖总体控制水平趋于稳定,合理的转诊制度对患者血糖管控及胰岛素方案制定大有益处。
7.1.10 出现严重降血糖药物不良反应难以处理的肿瘤患者
肿瘤患者使用降血糖药物在降低血糖的同时,可能会发生一些不良反应,主要包括胃肠道反应、代谢和营养障碍、肝功能损害、过敏反应及低血糖等[19]。常用降血糖药中,二甲双胍主要不良反应为胃肠道反应,其与乳酸性酸中毒发生风险间的关系尚不确定。SU最常见的不良反应为低血糖。TZD药物的使用与骨折和心力衰竭风险增加相关,且在与胰岛素或胰岛素促分泌剂联用时可增加低血糖的发生风险。格列奈类药物的常见不良反应是低血糖和体重增加。α-糖苷酶抑制剂单独用药通常不会发生低血糖。胰腺炎是DPP-4抑制剂较少见但很严重的不良反应。SGLT2抑制剂的常见不良反应为生殖泌尿道感染,罕见不良反应包括酮症酸中毒,可能的不良反应包括急性肾损伤(罕见)、骨折风险(罕见)和足趾截肢(见于卡格列净)。GLP-1受体激动剂的常见不良反应为胃肠道症状[2]。调查发现,糖尿病患者中药物性低血糖占62%,其中磺脲类降血糖药占37%,注射胰岛素占18%,双胍类降血糖药占7%,低血糖诊断明确后应立即处理,清醒者口服葡萄糖液或进食,昏迷者静脉推注50%的葡萄糖液40~100 mL,因格列本脲易导致反复低血糖,故应注意在静脉推注葡萄糖液后维持静滴葡萄糖液数小时至数天,另外,可使用胰高血糖素0.5~1.0 mg皮下或静脉注射直到病情完全稳定[20]。对于使用降血糖药物出现严重不良反应在基层医院难以处理者,应进一步转诊至上级医疗机构,重新制定降血糖方案,控制血糖水平,维持血糖稳定,减少降血糖药带来的不良反应。
7.1.11 医师判断患者合并其他需上级医院处理的情况或疾病
肿瘤患者如合并感染、抑郁症、严重心脑血管疾病等,若有手术指征,治疗较为复杂,需要鉴别良恶性,不具备外科手术、放化疗条件时,应及时向上转诊。治疗前后出现严重并发症,治疗后出现肿瘤复发或转移的患者也应及时向上转诊[21-23]。若患者出现血流动力学紊乱、血栓栓塞等严重并发症,基础疾病加重等情况时必须从基层医疗机构上转至二级及以上医院;而符合介入诊疗和手术适应证者,包括导管消融、左心耳封堵、外科治疗等,必须上转至三级医院[24]。
7.2 转回基层医疗卫生机构的标准
7.2.1 初次发现血糖异常,已明确诊断和治疗方案且血糖控制比较稳定
肿瘤患者初次发现血糖异常,经上级医院明确诊断并确定治疗方案,且治疗后血糖、血压和血脂控制达标,可转回基层医疗卫生机构。
7.2.2 糖尿病急性并发症治疗后病情稳定
常见糖尿病急性并发症包括DKA、糖尿病高渗性昏迷、糖尿病乳酸性酸中毒、严重低血糖[25]。发生DKA者在上级医疗机构治疗后酮体转阴、诱因去除、血糖稳定,意识障碍、深大呼吸、呼出气有烂苹果味等临床表现消失;糖尿病高渗性昏迷者血糖控制良好、症状缓解,临床表现意识障碍、脱水、低血压症状消失;低血糖患者意识障碍可有可无、饥饿感、四肢湿冷、心率增快、低血压症状消失,动态监测血糖>3.9 mmol/L,未再发低血糖患者可转回基层医疗卫生机构继续治疗[1,21]。
7.2.3 糖尿病慢性并发症已确诊并制定治疗方案和进行疗效评估,且病情已得到稳定控制
糖尿病慢性并发症包括视网膜病变、肾病、神经病变、DF和周围血管病变。微血管病变(视网膜病变、肾病、神经病变)患者满足以下条件可转回基层治疗:① 患者在当地中心医院或三级医院完成糖尿病微血管并发症的筛查项目;② 治疗方案确定且血糖基本控制稳定;③ 糖尿病微血管并发症患者的症状和体征得到控制或改善,医患双方均同意转回基层医疗卫生机构[13]。DF或周围血管病变患者满足以下条件可转回基层医疗机构治疗:患者在当地中心医院或三级医院完成DF的相关筛查;治疗方案确定且病情比较平稳,心肾等重要脏器功能较稳定;足部感染、骨髓炎及下肢缺血情况得到控制或有效改善(已予清创、截肢或血管重建等),创面肉芽新鲜、生长良好;医患双方均同意转回基层医疗卫生机构[14]。
7.2.4 其他经上级医疗机构医师判定可以转回基层医疗卫生机构继续治疗管理的患者
包括儿童和青少年(年龄<18岁)患者经过上级医疗卫生机构明确诊断及分型,制定治疗方案后可转回基层医疗卫生机构进行治疗管理,其次,妊娠和哺乳期妇女血糖异常者经上级医疗卫生机构治疗后血糖控制稳定者,以及出现严重降血糖药物不良反应、合并感染、抑郁症、严重心脑血管疾病等相关疾病时,经过上级医疗卫生机构治疗后病情平稳,血糖控制稳定者,可转回基层医疗卫生机构继续治疗管理[6]。
原文链接:http://www.cogonline.com/info/132732092669795000
